Las palabras vacunación y vacuna son derivadas del vocablo vacuno, ya que la primera forma de inmunización en humanos se realizó con la viruela bovina (cowpox, en inglés) para prevenir la viruela humana (smallpox, en inglés).
John M. González MD, Ph. D.
Profesor titular de la Facultad de Medicina, Universidad de los Andes
Esta dirección de correo electrónico está protegida contra spambots. Necesita activar JavaScript para visualizarla.
Juan Diego Zuluaga
Estudiante de la Facultad de Medicina, Universidad de los Andes
Esta dirección de correo electrónico está protegida contra spambots. Necesita activar JavaScript para visualizarla.
La vacunación como control de enfermedades infecciosas
Usando el método más antiguo de la ciencia, el observacional, el médico inglés Edward Jenner identificó cómo las ordeñadoras de vacas no presentaban viruela diseminada y grave, solamente lesiones en las manos a pesar de que estaban en contacto con las ubres de las vacas que presentaban lesiones de viruela vacuna. En 1796, Jenner inoculó un niño de ocho años con secreción de las pústulas de una ordeñadora de vacas para inducir protección en contra de la viruela humana, proceso conocido como variolización [1]. En ese tiempo no se conocía que eran los microorganismos, ni que el virus de la viruela de las vacas era diferente pero relacionado con la viruela humana. Tampoco se conocían los mecanismos inmunes y mucho menos existían las técnicas de laboratorio y moleculares con las que contamos hoy en día. Hasta ahora, la viruela ha sido la única enfermedad infecciosa erradicada de la faz de la tierra mediante vacunación. Algo totalmente diferente a lo que está sucediendo en el caso de la pandemia por COVID-19 que, completando un año, tiene más de doscientos candidatos de vacuna en diferentes fases de desarrollo [2]. El rápido crecimiento de los casos por el coronavirus SARS-CoV-2 en todo el mundo hace que en poco tiempo se saturen los sistemas de salud, además que no se cuente con la infraestructura y personal suficiente para atender la cantidad de casos complicados. La ausencia de tratamiento antiviral específico urge la necesidad del desarrollo de una vacuna para frenar el ciclo de enfermedad y su diseminación. [3]

Fuente: La vache et le vacciné : l’étonnante histoire du médecin qui a vaincu la variole - Le Parisien
Inmunidad inducida por vacunas
La inmunidad la podemos dividir en dos grandes brazos: la inmunidad innata y la inmunidad adaptativa.
La innata es la primera en actuar ante una infección y presenta mecanismos básicos, repetitivos y que no recuerdan el encuentro con el agente infeccioso. La adaptativa consta de la inmunidad humoral, en la que participan los anticuerpos que unen antígenos solubles o microorganismos, y la inmunidad celular que es mediada por linfocitos T y actúa a través de citocinas o de forma directa a través de la citotoxicidad en células infectadas por virus o células tumorales. En general, las vacunas inducen inmunidad adaptativa, y algunas de ellas, en especial las de microrganismos vivos, inducen inmunidad innata. Los anticuerpos y las células T (adaptativa) son las que usualmente se evalúan en los ensayos de vacunación. Las vacunas vivas que se replican en el cuerpo utilizan antígenos microbianos que se conocen como patrones moleculares asociados a patógeno (PMAP), los cuales se unen a receptores de reconocimiento de patrones (RRP) para inducir la actividad de la inmunidad innata. Por ejemplo, el ARN mensajero, como en el caso del virus SARS-CoV-2 es considerado un PMAP, el cual al unirse a los receptores de patrones intracelulares induce una respuesta inmune proinflamatoria y antiviral [4].
Correlatos de protección en vacunas
Un correlato es la asociación entre la inmunidad producida frente a una infección por un microorganismo o vacuna con las variables medibles, las cuales indican si una persona se protege de la infección o del desarrollo de la enfermedad. En el pasado, la identificación de correlatos de vacunas no fue la parte central de los estudios ya que después de mostrar seguridad, inmunogenicidad (véase glosario) y protección (efectividad), las vacunas fueron usadas para inmunización masiva. En estos casos, los posibles marcadores de protección fueron estudiados posteriormente. Los correlatos de la inmunidad inducida por la vacuna son importantes con el fin de evaluar la consistencia de la producción de lotes de vacuna, las susceptibilidades de los individuos y de las poblaciones después de la vacunación, y la validación de vacunas anteriores para las que no se conocían los correlatos y que ya tienen licencia [5]. Para algunas vacunas los correlatos son conocidos, por ejemplo, los anticuerpos neutralizantes de toxinas, como la vacunación contra la difteria o el tétanos protegen del desarrollo de la enfermedad. También, los anticuerpos neutralizantes en circulación (inmunoglobulina G, IgG) o en mucosa (inmunoglobulina A, IgA) protegen contra infecciones virales como virus respiratorios o gastrointestinales. Asimismo, la proliferación de linfocitos T se relaciona con protección en vacunación contra algunas infecciones virales [6] [7]. Al ser SARS-CoV-2 un virus ARN, se cree que estos mecanismos inmunes descritos también participan en el proceso de protección de la infección o la enfermedad. Se espera que los anticuerpos neutralizantes del virus y los linfocitos T CD8+ (o linfocitos citotóxicos) se asocien con la prevención y el control de COVID-19 [7].
Fases del desarrollo de las vacunas
Los estudios iniciales son denominados preclínicos, los cuales tienen como objetivo la selección de una molécula (antígeno) potencial candidata a vacuna contra un agente infeccioso. Los estudios preclínicos contemplan estudios epidemiológicos, por ejemplo, evaluando el espectro de la enfermedad y sus características (individuos protegidos versus no protegidos) hasta las ciencias básicas como el estudio del genoma, el proteoma y la respuesta inmune en personas que ya fueron infectadas. Así, se pueden definir los mecanismos inmunes que participan en la protección y qué antígenos de microorganismos son reconocidos por dicha respuesta. En esta fase se incluyen los estudios in vitro, por ejemplo, en cultivos celulares y los ensayos in vivo con modelos animales como ratones o primates.
Además de la selección de la molécula candidata, se estudian aspectos como la seguridad y toxicidad. Posteriormente, se debe producir con estándares para uso en humanos conocidos como buenas prácticas de manufactura (BPM), donde se trata de obtener la molécula en estado más puro posible, eliminando contaminantes para su uso en ensayos clínicos. Después de los estudios preclínicos, se continúa con los estudios clínicos que contemplan tres fases (tabla 1). En la fase 1 se vacuna un número reducido de voluntarios (< 50) para estudiar la seguridad del componente y la inducción de la respuesta inmune. Además, se evalúan aspectos como la ruta de inmunización, dosis y el adyuvante. El adyuvante (vehículo) es el componente que acompañará la vacuna, el cual en ocasiones puede ser tan importante como el mismo antígeno ya que protege la molécula y ayuda con la inmunogenicidad. En la fase 2 se aumenta el número de vacunados (> 100). Puede incluir un reto o infección controlada con el agente. En el caso del virus SARS-CoV-2 en esta fase no se realizará el reto por dos razones fundamentales: a) no se puede predecir el desenlace de la enfermedad en una persona que ha sido infectada y b) no existe tratamiento específico contra el virus. En la fase 3 se vacunan miles de personas (hasta 50.000) para evaluar la efectividad del candidato a vacuna aprovechando la presencia de la infección natural [2] [8]. Contra dos coronavirus previos (SARS y MERS) se inició el desarrollo de candidatos a vacuna, pero no se continuaron por baja circulación del virus. No obstante, algunos de estos candidatos son la base para el desarrollo de vacunas para SARS-CoV-2 [9].
Finalmente, debe obtenerse la aprobación por los entes reguladores de cada país y la producción masiva o escalamiento [2] [8]. Después, la aplicación masiva en la población se denomina fase 4.
| Fase | Aspectos estudiados | Tiempo | |
| Otras vacunas | COVID19 | ||
| Preclínica | — Estudios in vitro, por ejemplo, en cultivos celulares y ensayos in vivo con modelos animales | ± 5-10 años | ± 0 años |
| — Seguridad y toxicidad | |||
| — Inmunogenicidad | |||
| Fase 1 | — 20-50 voluntarios | ±3 años | ±6–9 meses |
| — Dosis y ruta administración | |||
| — Efectos adversos | |||
| — Adyuvante | |||
| Fase 2 | — 100-300 voluntarios | ±3 años |
±6-9 meses |
| — Seguridad | |||
| — Inmunogenicidad | |||
| Fase 3 | — 3.000-50.000 voluntarios | ±3 años | ±0 años |
| — Efectividad y protección | |||
| Aprobación por organismos de reguladores y control, p. ej.: FDA o EMAA | |||
| Fase 4 | — Producción, distribución y aplicación masiva | ± 1-2 años | ± 6 meses |
| Tiempo total | > 15 años | ± 18 meses | |
Tipos de vacunas
En general, las vacunas se pueden dividir en dos grandes grupos: las que se replican y las que no se replican. Las vacunas que se replican son organismos vivos que en general están atenuados, o sea se elimina su patogenicidad, pero siguen vivos. Por lo tanto, este tipo de vacunas se replican en el cuerpo y continúan estimulando la inmunidad. Como ejemplos tenemos vacunas contra agentes virales como sarampión, y bacterianas como la vacuna contra la tuberculosis. Las vacunas que no se replican pueden ser desde microorganismos inactivados o muertos, hasta componentes del microorganismo como subunidades, proteínas recombinantes o carbohidratos. Aunque las vacunas que no se replican inducen inmunidad, estas deben ser reforzadas en el tiempo ya que el antígeno desaparece después de la vacunación (tabla 2).
Principal blanco de vacuna para COVID-19
La proteína S es una de las tres proteínas de superficie del virus y recibe su nombre por la palabra spike, que significa espícula. La proteína de la espícula le da las proyecciones en forma de corona al virus y es la proteína encargada de mediar la entrada a las células (figura 1). La proteína S, a través del dominio de unión al receptor (RBD en inglés), se une al receptor en las células humanas conocido como ECA-2 o enzima convertidora de angiotensina [10].
Los anticuerpos contra este dominio evitan la entrada del virus a las células y por lo tanto se denominan anticuerpos neutralizantes [11]. También, la proteína S tiene la capacidad de inducir la respuesta de linfocitos T tanto ayudadores o CD4+, productores de citocinas que ayudan la respuesta inmune, y de linfocitos citotóxicos o CD8+ que se encargan de eliminar las células infectadas con el virus [12].
Tipos de vacuna para SARS-CoV-2
Basados en estudios previos con otros coronavirus y la respuesta inmune en SARS-CoV-2, la molécula seleccionada en vacunas para COVID-19 es la proteína S del virus. En cuanto a las estrategias que están en estudio se encuentran: virus atenuados, virus muertos o inactivados, subunidades (proteínas o péptidos), material genético (ARN o ADN) y vectores virales (figura 2). En las vacunas de virus atenuados, el virus es sometido a pases sucesivos en cultivos celulares para disminuir su capacidad de infección, reduciendo factores de virulencia, pero conservando su capacidad de replicarse. En el caso de las vacunas de virus muertos o inactivados, que se logra por medios físicos o químicos, estos no se replican en el organismo.
En ambos casos, en estos modelos de vacuna se utiliza el virus completo y la respuesta inmune será contra todos los antígenos que lo componen.
Las vacunas de subunidades están compuestas por proteínas del virus como la proteína S de SARS-CoV-2, la cual se puede producir de forma recombinante o sintetizada en forma de péptidos cortos. En las vacunas de ADN se usa el gen que codifica para la proteína S que al entrar en la célula se incorpora al núcleo celular y produce la proteína viral. En vacunas de ARN se sintetiza el ARN mensajero que corresponde a la proteína S, y dentro de una célula utiliza sus organelos para ser traducido a proteína. Finalmente, tenemos los vectores microbianos en los cuales se utiliza, por ejemplo, otro virus que ha sido atenuado y se le incorpora el gen que producirá la proteína S. Los vectores virales pueden replicarse o no en el individuo vacunado. En esta última forma de vacunación, algunos de los candidatos más avanzados para COVID-19 utilizan como vector viral adenovirus humano o de chimpancé.
| Vacunas | Estrategias de vacuna | Ejemplos | Ventajas | Desventajas |
| Se replican | Virus vivos atenuados* | Sarampión y rubeola |
|
|
| Virus recombinantes* | En estudio clínicos | |||
| Bacterias vivas atenuados | Fácil de administración |
|||
| Bacterias recombinantes | Otros beneficios no específicos | |||
| No se replican | Microorganismo completo inactivados* | Polio y rabia |
|
|
| Proteínas o toxoides purificadas | Tétanos y difteria | |||
| Carbohidratos purificados | Neumococo | |||
| Proteínas recombinantes* | Hepatitis B | |||
| Péptidos sintéticos* | En estudio clínicos | |||
| Ácidos nucleicos (adn o arn) * | En estudio clínicos |
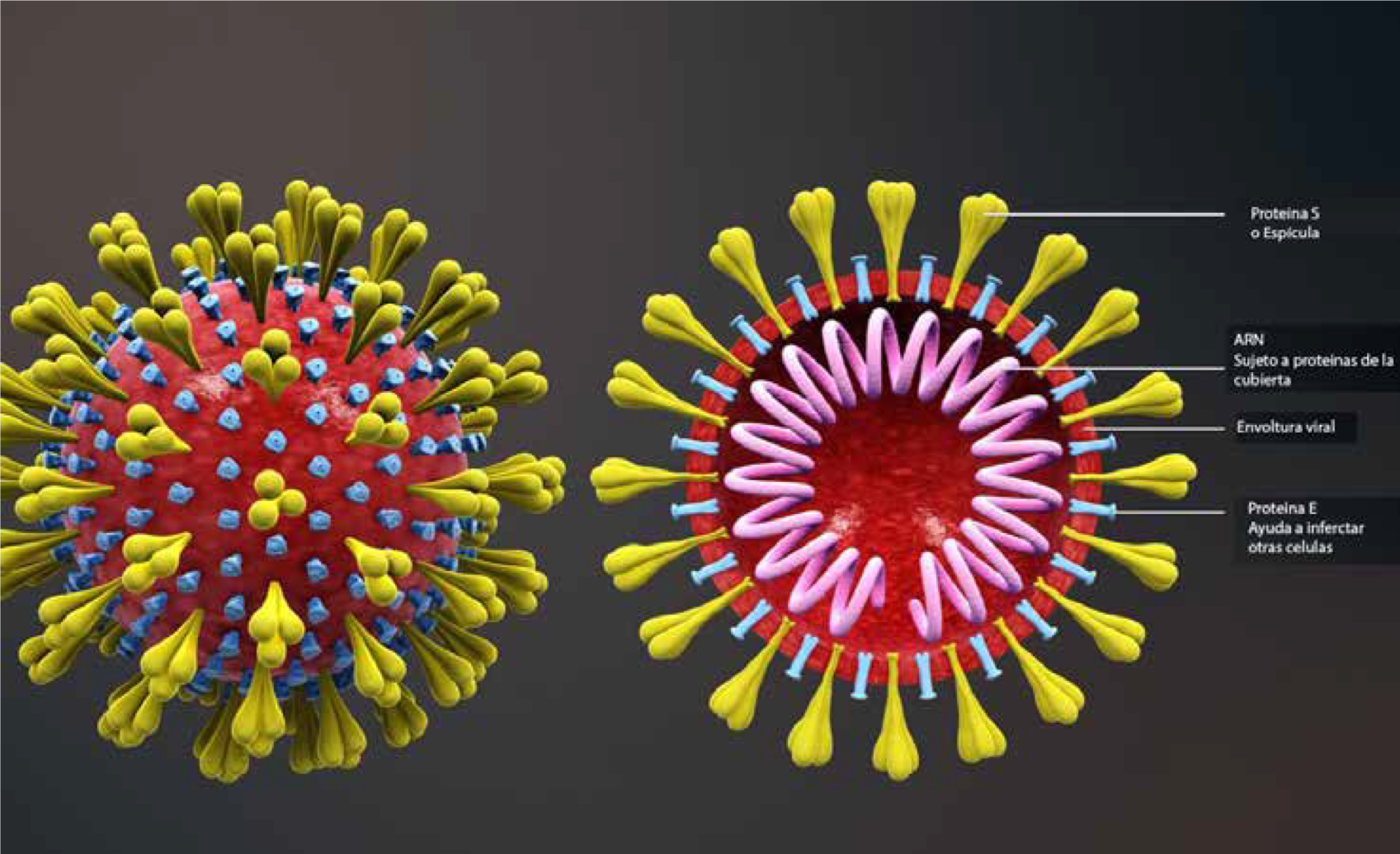

Figura 1. Esquema de la proteína de la espícula del virus SARS-CoV-2 La envoltura del virus se muestra en color rojo donde se encuentra anclada la proteína S o espícula que se muestra en color amarillo. La proteína S está compuesta por tres unidades (trímero). El dominio de unión al receptor, esta es la parte que se une al receptor ECA-2 presente en las células humanas.
Fuente. https://www.empireo.es/infeccion-por-coronavirus-y-otros-virus/.
Vacunas para COVID-19
Una posible cronología para el desarrollo de la vacuna COVID-19 contemplaría al menos 18 meses distribuidos así: a) fases 1/2 con una duración de seis meses cada una, b) salto a la fase 3, según criterios de emergencia, y c) seis meses para fabricación y distribución, con un total de dieciocho meses (tabla 1). Por ejemplo, el candidato a vacuna de la farmacéutica Moderna fue la primera en iniciar ensayos clínicos en Estados Unidos aplicando las primeras dosis tan solo 63 días después de seleccionar la secuencia de ARN mensajero a usar.
Para octubre del 2020, la Organización Mundial de la Salud (OMS) reportó que había 44 candidatos en ensayos clínicos y 154 en estudios preclínicos. (https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines).Los objetivos para vacunar contra SARS-CoV-2 son: a) prevenir los síntomas clínicos o enfermedad severa que pueda requerir hospitalización, b) prevenir la transmisión de la enfermedad y c) inducir una respuesta inmune contra la proteína S, inhibiendo la entrada del virus a las células por medio de anticuerpos neutralizantes [8].Las moléculas que se encuentran en fase 3 son las que tienen más probabilidades de ser aprobadas en los próximos meses por los organismos de control para su distribución y aplicación masiva.
Con respecto a las vacunas de virus muerto o inactivado, actualmente se encuentran tres candidatos estudios de fase 3, todas provenientes de China: Sinovac Biotech (CoronaVac) [13], Beijing Institute of Biological Products/Sinopharm (BBIBP-CorV) [14] y Wuhan Institute of Biological Products/Sinopharm [15]. Estas vacunas tienen además en común que fueron inactivadas con b-propiolactona, tienen hidróxido de aluminio como adyuvante y se aplican en dos dosis. Los estudios de fase 1/2 demostraron inducción de anticuerpos de unión y neutralizantes; solo un estudio evaluó inmunidad celular, pero no se detectó respuesta [15].
Con la vacuna BBIBP-CorV en primates se demostró protección al desarrollo de neumonía por SARS-CoV-2 [16]. Las compañías chinas están realizando ensayos en Emiratos Árabes Unidos, Perú, Marruecos, Argentina, Brasil, entre otros [17].
La vacuna Novavax desarrollada en el Reino Unido es la única basada en subunidad proteica que se encuentra en ensayos de fase 3. Está compuesta de la proteína S completa con derivados de saponina como adyuvante. En fase 1/2 esta vacuna fue segura, indujo anticuerpos neutralizantes y respuesta de linfocitos T [18]. La compañía indica que se aplicará la vacuna hasta a 10.000 voluntarios en Reino Unido y podrían tener resultados para el primer trimestre del 2021 [19].
Dos candidatos a vacuna se componen de ARN mensajero y actualmente se encuentran en estudios de fase 3: Moderna/NIAID (mRNA-1273) y BioNTech/Pfizer/Fosun Pharma (BNT162b1).
El ARN mensajero de la vacuna de Moderna codifica para la proteína S completa y el ARN de BioNTech/Pfizer/Fosun Pharma para el dominio de unión al receptor (RBD). Ambas secuencias se empaquetan en nanopartículas lipídicas, las cuales facilitan que la secuencia de ARN llegue al citoplasma de la célula donde será traducida a proteína. Ambas usan dos dosis intramusculares, y ya se publicaron datos alentadores sobre su seguridad e inmunogenicidad [20] [21]. Una de las principales limitaciones de esta estrategia de vacunación es la seguridad, ya que hasta el momento no se ha aprobado la primera vacuna de ARN para su uso en humanos. [2].
En el grupo de las vacunas de vector viral, la mayoría han apostado por el uso de adenovirus atenuados que expresan el gen de la proteína S. La vacuna de CanSino Biologics (China) utiliza adenovirus humano 5; actualmente se encuentra aprobada por las autoridades de este país para uso limitado en la milicia [22]. La vacuna rusa Sputnik V usa adenovirus humanos 5 o 26; fue la primera vacuna “registrada” en el mundo y esperan completar los ensayos de fase 3, al mismo tiempo que se realiza una distribución masiva de la vacuna en la población [23]. La vacuna de AstraZeneca/Universidad de Oxford (ChAdOx1) utiliza un adenovirus de chimpancé [24].
Estas vacunas de vectores virales en estudios de fase 1/2 se aplicaron en dos dosis y han demostrado ser seguras e inducir una buena respuesta de anticuerpos neutralizantes SARS-CoV-2; además de estimular la respuesta de linfocitos T. La evaluación de la respuesta inmune celular en estas vacunas descritas fue medida con diferentes metodologías, lo que hacen estos datos poco comparables [22] [23] [24].
El uso de un adenovirus del chimpancé (AstraZeneca/Universidad de Oxford) minimiza la posible interacción con los anticuerpos prevalentes contra este, algo que puede presentarse con las vacunas de adenovirus humanos. Cerrando este grupo, se encuentra la vacuna de Johnson & Johnson que usa como vector adenovirus 26; la compañía inició en septiembre del 2020 estudios de fase 3. Este candidato en estudios en primates demostró inmunogenicidad y protección de infección contra el virus [25].

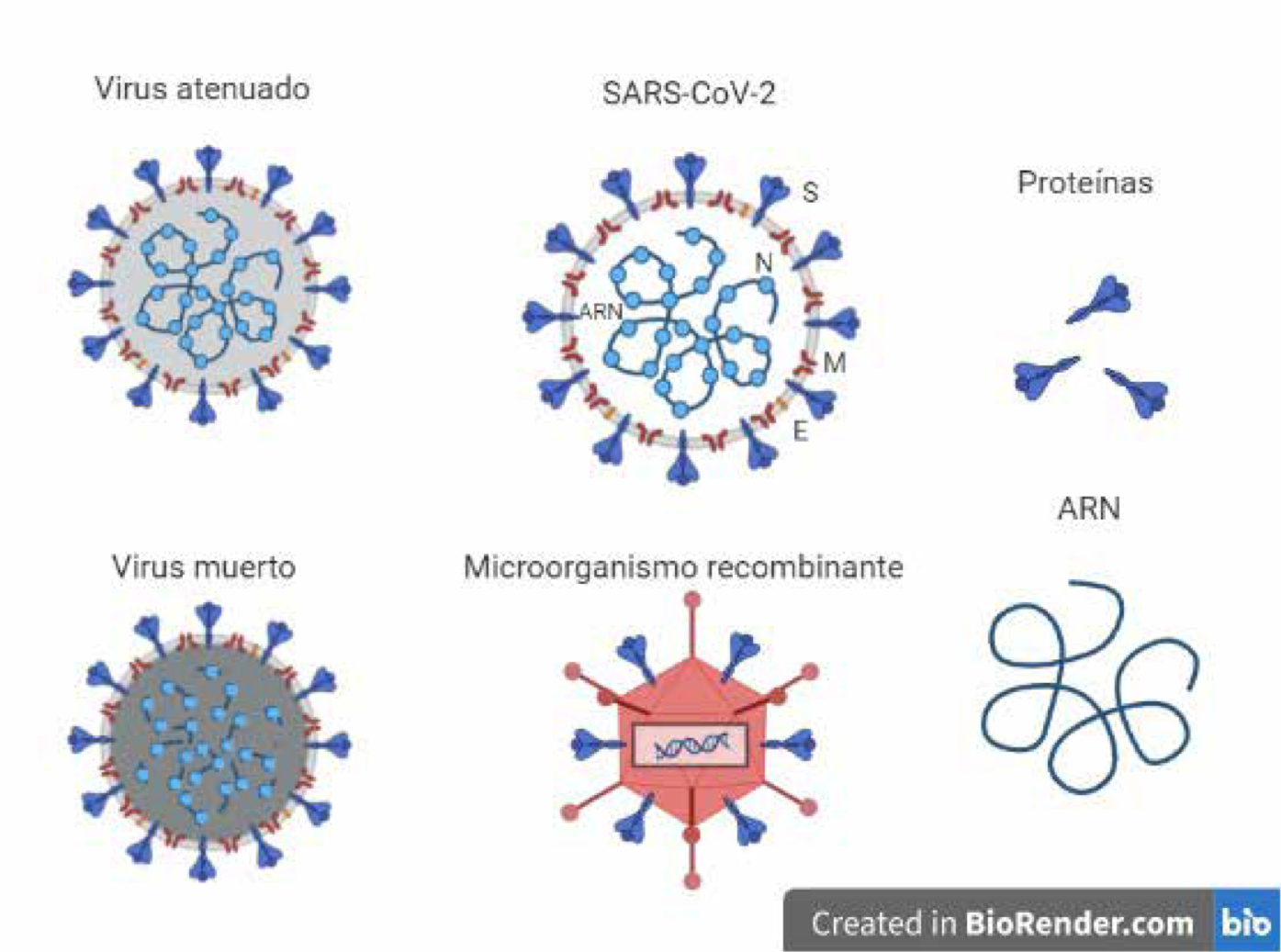
Figura 2. Tipos de vacunas en estudio en COVID-19
Esquema que representa el virus SARS-CoV-2. Las proteínas estructurales se encuentran demarcadas por la letra. Nucleoproteína (N), membrana (M), envoltura (E) y espícula (S). Figura elaborada con Biorender (Biorender.com)
Comentario final
En general, las vacunas en fase 1/2 produjeron reacciones adversas leves a moderadas, indujeron inmunogenicidad y la mayoría de los estudios fueron realizados en personas de 18 a 65 años; solo dos estudios incluyeron mayores de 65 años. Hasta el momento no se han involucrados niños ni mujeres embarazadas. Igualmente, no se conoce el correlato de protección, pero la respuesta de anticuerpos de unión y neutralizantes fueron comparados en algunos estudios con plasma de individuos convalecientes.
Nunca en la historia del desarrollo de una vacuna se había avanzado tanto en un año como con la vacuna para COVID-19, al punto que con los resultados parciales de la fase 3 se ha aprobado para uso de emergencia en humanos la vacuna de Pfizer en Inglaterra y se espera la aprobación de las vacunas de Pfizer y Moderna por parte de la FDA en Estados Unidos durante la segunda semana de diciembre del 2020. Dos nuevas formas de estrategia de vacunación están siendo usadas como son el uso de ARN mensajero y vectores virales (adenovirus). Todos estos avances y el conocimiento generado claramente ayudarán a acelerar el desarrollo de otras vacunas para agentes infecciosos emergentes o para los cuales no existe aún vacuna.
Agradecimientos
Los autores agradecen a la doctora Elizabeth Castañeda Ph.D. por la revisión del manuscrito y sus comentarios.
Glosario sobre vacunas
Adyuvante: compuesto que acompaña la vacuna, entrega y protege la molécula. Del latín adiuvare, “ayudar”.
Antígeno: es una molécula que es reconocida por parte del sistema inmune. P. ej. antígeno viral.
BMP: buenas prácticas de manufactura son procesos para producir la vacuna de uso clínico.
Efectos adversos: efecto dañino no deseado resultado de una intervención.
Efectividad: capacidad de una vacuna para proteger al huésped en condiciones ideales.
Escalamiento: procesos por el cual se produce de forma masiva el componente de la vacuna.
Inmunidad innata: se conoce también como inmunidad natural, la cual nos defiende de forma inicial contra las agresiones.
Inmunidad adaptativa: reconoce un antígeno microbiano de forma específica. Se compone de anticuerpos y linfocitos T.
Inmunogenicidad: capacidad de un antígeno de inducir una respuesta inmune.
Recombinante: una proteína recombinante es la obtenida al expresar un gen en una célula diferente a la original que la produce.
Virulencia: es el nivel en el que un microorganismo puede producir daño (patogénico).
Referencias
[1] Riedel S. Edward Jenner and the History of Smallpox and Vaccination. Baylor Univ. Med. Cent. Proc. 2005; 18(1): 21-25.
[2] Chung YH, Beiss V, Fiering SN, Steinmetz NF. covid-19 Vaccine Frontrunners and Their Nanotechnology Design. acs Nano, 2020.
[3] Wang L, Wang Y, Ye D, Liu Q. Review of the 2019 novel coronavirus (sars-CoV-2) based on current evidence. Int. J. Antimicrob. Agents jun. 2020; 55(6): 105948.
[4] Vabret N et al. Immunology of covid-19: Current State of the Science. Immunity 2020: 910-941.
[5] Plotkin SA. Correlates of protection induced by vaccination. Clin. Vaccine Immunol. 2010; 17(7): 1055-1065.
[6] Den Hartog G, Van Binnendijk R, Buisman AM, Berbers GAM, Van der Klis FRM. Immune surveillance for vaccine-preventable diseases. Expert Rev. Vaccines 2020; 19(4): 327-339.
[7] Hellerstein M. What are the roles of antibodies versus a durable, high quality T-cell response in protective immunity against sars-CoV-2? Vaccine 2020; X (6): 100076.
[8] Calina D. et al. Recent advances, approaches and challenges in targeting pathways for potential covid-19 vaccines development. Immunol. Res. Oct. 2020: 1-10.
[9] Lee P, Kim DJ. Newly emerging human coronaviruses: Animal models and vaccine research for sars, mers, and covid-19. Immune Netw. 2020: 20 (4): 1-25.
[10] Huang Y, Yang C, Feng Xu X, Xu W, Wen Liu S. Structural and functional properties of sars-CoV-2 spike protein: Potential antivirus drug development for covid-19. Acta Pharmacol. Sin. 2020; 41(9): 1141-1149.
[11] Ju B et al. Human neutralizing antibodies elicited by sars-CoV-2 infection. Nature 2020; 584 (7819): 115-119.
[12] Grifoni A et al. Targets of T Cell Responses to sars-CoV-2 Coronavirus in Humans with covid-19 Disease and Unexposed Individuals. Cell 2020; 181 (7): 1489-1501.e15.
[13] Zhang Y et al.. Immunogenicity and Safety of a sars-CoV-2 Inactivated Vaccine in Healthy Adults Aged 18-59 years: Report of the Randomized, Double-blind, and Placebo-controlled Phase 2 Clinical Trial. medRxiv Prepr., 2020.
[14] Xia S et al. Safety and immunogenicity of an inactivated sars-CoV-2 vaccine, bbibp-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infect. Dis. Oct. 2020; January: 19-21.
[15] Xia S et al. Effect of an Inactivated Vaccine Against sars-CoV-2 on Safety and Immunogenicity Outcomes: Interim Analysis of 2 Randomized Clinical Trials. jama - J. Am. Med. Assoc. 2020; 324 (10): 951-960.
[16] Wang H et al. Development of an Inactivated Vaccine Candidate, bbibp-CorV, with Potent Protection against sars-CoV-2. Cell 2020; 182 (3): 713-721.e9.
[17] Corum J, Wee SL, Zimmer C. Coronavirus Vaccine Tracker. 2020. [Online]. https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html?name=styln-coronavirus-vaccines®ion=TOP_BANNER&block=storyline_menu_recirc&action=click&pgtype=Article&impression_id=819b8b00-1b45-11eb-9614-d9b74dcdf362&variant=1_Show
[18] Keech C et al. Phase 1-2 Trial of a sars-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N. Engl. J. Med. 2020: 1-13.
[19] Thomas K, Zimmer C. Novavax Enters Final Stage of Coronavirus Vaccine Trials. Sept. 24, 2020. [Online]. https://www.nytimes.com/2020/09/24/health/covid-19-vaccine-novavax.html
[20] Jackson LA et al. An mrna Vaccine against SARS-CoV-2 - Preliminary Report. N. Engl. J. Med., Jul. 2020.
[21] Mulligan M et al. Phase 1/2 Study to Describe the Safety and Immunogenicity of a covid-19 rna Vaccine Candidate (bnt162b1) in Adults 18 to 55 Years of Age: Interim Report. 2020.
[22] Zhu FC et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored covid-19 vaccine in healthy adults aged 18 years or older: A randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2020; 396 (10249): 479-488.
[23] Logunov DY et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost covid-19 vaccine in two formulations: Two open, non-randomised phase 1/2 studies from Russia. Lancet 2020; 396 (10255): 887-897.
[24] Folegatti PM et al. Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against sars-CoV-2: A preliminary report of a phase 1/2, single-blind, randomised controlled trial. Lancet 2020; 396 (10249): 467-478.
[25] Mercado NB et al. Single-shot Ad26 vaccine protects against SARS-CoV-2 in rhesus macaques. Nature Oct. 2020; 586: 583-588.
Crédito imagen de portada: VEESLER LAB/UNIVERSITY OF WASHINGTON https://www.eurekalert.org/multimedia/721448