Juan Armando Sánchez. Profesor titular. Laboratorio de Biología Molecular Marina (biommar). Departamento de Ciencias Biológicas.
Entrados en el Antropoceno, tanto los cambios ambientales como los sociales se están dando de forma acelerada. Imposible hacer predicciones sobre un futuro que genera, ante todo, una gran incertidumbre. Aunque es difícil de imaginar, no podemos descartar un cambio del paisaje arrecifal en el que es posible que veamos otros tipos de corales, quizás almejas gigantes y, posiblemente, muchas algas calcáreas.
Es indiscutible que los arrecifes coralinos son uno de los ecosistemas más amenazados de la Tierra. Los efectos directos del aumento de las temperaturas sobre los corales se han documentado en detalle desde la década de los ochenta [1]. Todo el andamiaje ecosistémico de los arrecifes depende del depósito de carbonato de calcio producto de los esqueletos coralinos, los cuales, a su vez, dependen del aporte de sus endosimbiontes mutualistas, dinoflagelados fotosintéticos, comúnmente conocidos como zooxantelas. Con el aumento de las temperaturas se produce el fenómeno de blanqueamiento coralino, en el que se interrumpe la fotosíntesis en las zooxantelas y se generan moléculas inestables con oxígeno que ocasionan la expulsión de los dinoflagelados y muchas veces daño celular tanto en el huésped como en el hospedero [2]. Sin embargo, este no es el único factor que incide en el fenómeno de blanqueamiento; el exceso de radiación, causado por la poca nubosidad o por la superficie del mar en calma, también lo promueve. En algunas ocasiones, el blanqueamiento coralino puede estar asociado con el desbalance en las abundancias de las poblaciones microbianas en la microbiota coralina (disbiosis) o, incluso, con patógenos de las zooxantelas.
La simbiosis entre corales y zooxantelas está muy amenazada por el cambio climático. Entre los motivos, se encuentran los siguientes: primero, que la temperatura óptima en la que ocurre esta interacción es muy cercana a la temperatura en la que se produce el blanqueamiento coralino. Segundo, que las zooxantelas tienen pocos recursos para fotoaclimatarse, pues tienen un sistema fotosintético bastante singular: carecen de clorofila b y tienen enzimas RuBisCO de tipo II, a diferencia de las algas verdes y las plantas [3]. La situación es preocupante pues los servicios ecosistémicos que recibimos de los arrecifes coralinos se están perdiendo de forma acelerada, lo que amenaza la sostenibilidad de millones de personas que se benefician directa e indirectamente de estos frágiles ecosistemas [4]. En la última década, se ha generado un debate entre los científicos sobre cuál debe ser el enfoque para prevenir la pérdida de los corales y los arrecifes coralinos. Muchos se han movilizado para apoyar los procesos de restauración de las poblaciones de corales mediante las técnicas de guarderías coralinas [5]. Allí se clonan pequeños fragmentos de coral que se siembran en estructuras alejadas del arrecife y en los que se remueven, de forma manual, algas y otras amenazas que puedan amenazar los retoños coralinos [6]. Algunos pocos proyectos han logrado reproducir corales a partir del trasplante de larvas y, por ello, la mayoría utiliza fragmentos de los mismos corales que sobreviven en el arrecife. Luego de uno o dos años, cuando los fragmentos de coral han alcanzado un tamaño adecuado, los corales de «vivero» se plantan nuevamente en el arrecife mediante cementos especiales.
El crecimiento de los fragmentos en guarderías es muy exitoso en comparación con la modesta sobrevivencia de los fragmentos trasplantados. Algunos esfuerzos de investigación, en Australia especialmente, con inversiones millonarias en ciencia básica y aplicada, buscan modificar genéticamente los corales y las zooxantelas para que soporten mayores temperaturas y, así, mediante las técnicas de guarderías coralinas, repoblar los arrecifes con corales más «aptos» para enfrentar las cambiantes condiciones del ambiente [7]. Es curioso que muchas de las empresas del sector energético sean las principales financiadoras de estos proyectos de investigación, cuando han sido estas mismas las que mantienen —y no buscan reducir— sus niveles de emisión de gases de efecto invernadero (GEI), la principal causa del blanqueamiento coralino.
 Figura 1. Corales duros (Scleractinia, Anthozoa, Cnidaria) constructores de arrecifes, incluyendo varias especies de Acropora, en las costas de Dahab, Egipto, mar Rojo (fotografía tomada por Juan A. Sánchez).
Figura 1. Corales duros (Scleractinia, Anthozoa, Cnidaria) constructores de arrecifes, incluyendo varias especies de Acropora, en las costas de Dahab, Egipto, mar Rojo (fotografía tomada por Juan A. Sánchez).
Sin embargo, no solo resistir al incremento de las temperaturas es suficiente para que los corales logren recuperarse de décadas de degradación. Además de las altas temperaturas, los corales enfrentan otras condiciones degradantes del ambiente; por ejemplo, el océano ha sufrido cambios en otras condiciones ambientales que han socavado la resiliencia de los ecosistemas, es decir, su capacidad de regresar a su estado original, al punto que los arrecifes probablemente no volverán a parecerse nunca a los que describió la ciencia en los años cincuenta [8]. Hoy en día, muchos arrecifes coralinos carecen de integridad ecosistémica, en la que los grandes depredadores como meros y tiburones han desaparecido de la escena. Aún más preocupante, el número de peces herbívoros, como los peces loro, se ha diezmado de forma considerable, debido, también, a la sobreexplotación pesquera de las últimas décadas. Sin los peces loro, que son los mayores herbívoros en el arrecife, las algas de crecimiento rápido se convierten en competidores directos de los corales [9]. Esto, sumado a que los arrecifes coralinos en zonas costeras reciben una mayor carga de sedimentos y nutrientes provenientes de los ríos, lo que hace que las algas aprovechen esta fertilización y monopolicen el espacio a costa de la muerte lenta de los corales. La suma de la alteración del ecosistema se manifiesta con un desbalance de los nutrientes, como el fósforo, ahora acaparado por las algas y por un exceso en formas de carbono orgánico disuelto de tipo lábil, rico en polisacáridos [10]. Esto afecta de forma directa las microbiotas y las comunidades de microorganismos que habitan tanto en el agua como en los organismos del fondo, lo que promueve las disbiosis y las enfermedades coralinas, lo que a su vez, de forma indirecta, causa la desaparición lenta de los corales y diezma el éxito de las guarderías coralinas [11].
Otra situación derivada del cambio climático es la acidificación oceánica. Se trata de un cambio en la química del agua del mar en respuesta al aumento de dióxido de carbono en la atmósfera, el cual se convierte en CO2 acuoso, es decir, en un ion de bicarbonato (HCO3-) y un hidrogenión o catión de hidrógeno (H+). Por un lado, este fenómeno reduce el ion de carbonato, necesario para depositar el carbonato de calcio (CaCO3), y que los corales, el plancton y los crustáceos usan —junto con los iones de calcio (Ca2+)— para construir sus esqueletos y conchas en un proceso conocidocomo calcificación. Por otro lado, el exceso de hidrogeniones baja el pH del mar, volviéndolo ácido [12]. Técnicamente esto afecta la alcalinidad del agua, pues el mar es más básico que ácido y se alcanza un umbral preocupante cuando la saturación del ion carbonato se pierde. Lo anterior afecta, primeramente, a los organismos cuya su cristalización del carbonato de calcio es aragonita —y su umbral llamado el omega de aragonita (Ωarag)—, mientras que los organismos que depositan calcita (ΩCa) se afectan menos, es decir, soportan en cierta medida la acidificación oceánica.
Las soluciones para detener la degradación de los arrecifes coralinos saltan a la vista, pero su implementación requiere del fomento de una cultura que va en contravía a los medios de desarrollo humano actual. Sobre todo, la mitigación de los efectos del cambio climático es un requisito sine qua non para evitar el fenómeno de blanqueamiento coralino. El problema está en que, incluso si se realiza una transformación energética de forma inmediata, son necesarias medidas que extraigan de la atmósfera el exceso de GEI que hay en la actualidad, y pasarían décadas para llegar a los niveles preindustriales [13]. Las fuentes locales de degradación, como la sobrepesca y el exceso de nutrientes, son quizás más fáciles de controlar en el corto y mediano plazo. Los arrecifes coralinos se distribuyen, en su mayoría, por la franja tropical húmeda, que pasa por países como Colombia; en estos, la sobreexplotación pesquera es también un producto de la desigualdad social, por lo que es necesario desarrollar programas que propendan por el consumo responsable de este tipo de recursos, sobre todo, cuando estos constituyen la primera opción de consumo entre la población. Además, muchos de estos países carecen de programas para tratar aguas servidas, en especial para reducir la carga de nutrientes, como el nitrógeno y fósforo, que vierten sus ríos [14].
Con algunas excepciones en lugares muy remotos, los arrecifes coralinos han cambiado considerablemente en las últimas décadas. Es inverosímil pensar que con viveros coralinos logremos reconstruir los arrecifes coralinos que hemos perdido a lo largo de estos años. Por ello, otros científicos nos hemos enfocado en soluciones alternativas y en buscar las especies de corales y las características de los ecosistemas que, pese a las cambiantes condiciones, han logrado prevalecer. Si bien todos los esfuerzos son válidos para frenar la degradación de los arrecifes coralinos, solo un enfoque evolutivo nos puede llevar a predicciones y medidas de manejo más realistas para este valioso ecosistema.
Arrecifes coralinos: un museo de la obsolescencia
Luego de estudiar toda su carrera los arrecifes coralinos en el registro fósil, el conocido paleontólogo marino, George Stanley, llegó a la conclusión de que los arrecifes coralinos actuales son un museo de la obsolescencia de organismos que construyen arrecifes coralinos [15]. Es como si en una ciudad como Nueva York todavía se mantuvieran todos los sistemas de transporte que han existido: las carrozas con caballos, el tren a vapor, el tranvía, el metro subterráneo, los buses, carros, taxis y motos de todos los modelos. Si bien el metro es el medio que más personas moviliza, si este hiciera falta, sobrarían los medios de transporte para moverse por la ciudad si esto fuera necesario: así son los arrecifes coralinos. Aunque los corales escleractínios (Anthozoa) son los principales constructores de roca arrecifal, en los arrecifes coralinos también encontramos otros grupos de organismos, que aún no son tan abundantes, y que también pueden depositar roca dura, como los corales de fuego (Hydrozoa), octocorales (Anthozoa), almejas gigantes (Gastropoda) y algas coralináceas (Rhodophyta). Incluso los estromatolitos que existieron hace varios miles de millones de años, aún se encuentran en lugares como Las Bahamas. Todos estos organismos utilizan la fotosíntesis, de forma directa o a través de simbiosis con microalgas, para tener altas tasas de crecimiento y, aunque hoy en día no son los principales constructores arrecifales, podrían serlo en el futuro.
Hace más de cien millones de años, las almejas del grupo de los rudistas eran los principales constructores arrecifales, que luego de su extinción —al parecer debido al mismo evento que hizo desaparecer a los dinosaurios— dejaron libre el nicho para los corales que prevalecieron hasta hoy en día [16]. ¿Podría darse un cambio en la construcción arrecifal debido al cambio climático? Si bien se han documentado muchos cambios en los constructores arrecifales en el registro fósil, hoy esta sería una situación indeseable que, de ocurrir en un futuro cercano, tendría consecuencias nefastas para las comunidades costeras.
El registro fósil también muestra cómo se perdió la saturación de Ωarag, lo que dio vía libre a que organismos como calcita dominaran entre los constructores arrecifales. Los periodos ácidos del océano no fueron fáciles para los organismos marinos, pero la presión evolutiva hizo que surgieran diversos tipos de esqueletos, algunos combinados con proteínas córneas, en los octocorales, justo en esos tiempos difíciles hace más de cien millones de años [17].
Muchas de estas innovaciones evolutivas para depositar carbonato de calcio se encuentran aún en diversas especies de octocorales en los arrecifes coralinos. Algunos de los octocorales del tipo coral blando, que abundan en el Indopacífico, son corales duros como el coral azul y el coral órgano de tubos y otros depositan en sus bases la espiculita, un conglomerado de un esqueleto granular de calcita.
En varias partes del mundo existen torres de depósitos de espiculita, que no se alejan mucho de la roca secretada por un coral promedio. En los arrecifes coralinos del sur de Japón se hizo un hallazgo sorprendente en un tramo costero naturalmente acidificado por fuentes naturales de dióxido de carbono en el que encontraron que solamente los octocorales eran capaces de vivir en esta zona, mientras que los corales duros desaparecían por completo [18]. ¿Será que estos arrecifes de Japón son una ventana del futuro de los arrecifes coralinos? Es promisorio pensarlo, pues pese al declive de los corales escleractínios, no perderíamos el ecosistema como tal, sino que tendríamos un ecosistema con una composición diferente. En el mar Caribe abundan otrosoctocorales, gorgonáceos, que, aunque mayoritariamente blandos y con un endoesqueleto proteínico, depositan en sus bases el carbonato de calcio de manera similar a lo que ocurre en un coral pequeño. Por ejemplo, la cantidad de gorgonáceos ha aumentado de forma abrupta su abundancia en las últimas dos décadas, pese al acelerado deterioro de los corales duros [19,20]. Experimentos en condiciones de mesocosmos, en los que se añaden burbujas de dióxido de carbono para simular un océano acidificado, han demostrado la gran capacidad de los gorgonáceos para prevalecer pese a condiciones ácidas. Incluso con niveles por debajo de la saturación de ΩCa, los gorgonáceos continuaban creciendo y calcificando sus esqueletos granulares [21]. Si bien sus depósitos son menores que los de espiculita, la abundancia de los gorgonáceos podría contrarrestar dicha situación. Quizás exista una historia similar con los corales de fuego en otro lugar del mundo o con las almejas gigantes. Quizás perderemos algunos servicios ecosistémicos de los arrecifes coralinos, al menos durante algunas generaciones, pero el ecosistema resurgirá como lo ha hecho desde que existen en el registro fósil.
Corales hongo Agaricia: ¿más duros de lo que parecen?
Muchas especies de corales escleractínios se encuentran en la lista roja de la Unión Internacional para la Conservación de la Naturaleza (UICN), entre ellos están dos especies del género de corales Acropora, cuerno de alce y de ciervo, que fueron los principales constructores de arrecifes en el mar Caribe. En las islas del Rosario (Cartagena, Bolívar) existía una barrera de once kilómetros con una ancha franja de Acropora en el frente arrecifal [22]. A pesar de que los esfuerzos en viveros de las especies de Acropora se concentran principalmente a lo largo y ancho del gran Caribe, incluso si esta técnica funciona para recuperar a las dos especies de Acropora, las actuales generaciones humanas no veríamos su recuperación total. En los últimos años, una familia de corales cerebro (Meandrinidae) —que incluye corales tan icónicos como el coral catedral (Dendrogyra cilindrus)— es particularmente susceptible a una nueva enfermedad coralina que apareció en los cayos de la Florida y que se ha extendido paulatinamente por todo el Caribe: la SCTLD, llamada así por sus siglas en inglés (Stony Coral Tissue Loss Disease) [23]. Hoy la especie ha desaparecido de la Florida [24] y se desconoce su estado actual, pero no sería raro que fuéramos testigos de la extinción de especies de corales duros en los próximos años. ¿Están todas las especies de coral en una situación similar de amenaza?
Una forma de encontrar corales resilientes y resistentes a las condiciones cambiantes es buscarlos bajo condiciones ambientalmente estresantes. Los arrecifes coralinos del Caribe colombiano están expuestos a las descargas de grandes ríos como el Magdalena, el Sinú y el Atrato. La alta sedimentación y elevadas concentraciones de nutrientes se consideran condiciones limitantes para el desarrollo coralino. No obstante, existen arrecifes coralinos bien desarrollados en estas condiciones [25] y algunas especies, como el coral lechuga Agaricia (=Undaria) tenuifola, parecen alcanzar su máxima abundancia en los arrecifes bajo mayor influencia continental, al crecer en forma de panal con sus hojas verticales y así evitar el sofocamiento por sedimento [26]. Esta especie tiene una distribución caprichosa en el Caribe, habita desde Colombia hasta Belice, pero no se encuentra en las Antillas, Las Bahamas o Florida.
Cuando los científicos que solían trabajar en esas regionesvieronlasgranabundanciadeestecoral en los arrecifes de Belice y Panamá, sugirieron que se trataba de un coral tipo «maleza» y oportunista que aprovechó la mortandad de Acropora para expandirse con rapidez [27]. Al estudiar este coral, uno realmente se da cuenta de que sus preferencias ambientales traslapan un poco con las especies de Acropora, pero no ocupan su mismo ambiente, y en los lugares donde no sobrevivirían los corales cuerno, el coral lechuga es de los pocos que logra hacerlo. Además, se asocian cientos de animales y algas bajo sus esqueletos y sobre los ambientes que cubre. Pensar que los ecosistemas tienen un molde que se debe seguir en todas las regiones, puede ocultar los patrones que estamos buscando hoy en día para entender la crisis por la que atraviesan los corales [28].
Dentro de la modesta diversidad de corales duros del mar Caribe, las especies de Agaricia son el grupo más diverso, con más especies, y con una gran capacidad de aferrarse a todos los ambientes del arrecife coralino, incluyendo la zona mesofótica [29]. Esta zona, también conocida como la zona del crepúsculo por tener menos del 1% de la radiación solar que llega a la superficie del mar, alberga algunos corales constructores de arrecifes coralinos entre cuarenta y ciento cincuenta metros de profundidad. Este ambiente arrecifal nos ha llamado mucho la atención pues, aunque ocurren los cambios ambientales más drásticos de la columna de agua —disminuye la luz, los nutrientes, el fitoplancton, la densidad del agua, entre otros—, lo que promueve la diversificación de especies, ha sido muy poco explorada [30]. También, al estar expuesta a muy poca luz y un tanto menos de temperatura que la superficie, es un refugio ante los acelerados cambios ambientales [31].
Asimismo, si estamos tras la búsqueda de adaptaciones antiguas, aparentemente obsoletas, este lugar tan poco perturbado es un ambiente ideal para ello. Fue allí donde encontramos otra especie de Agaricia, el coral hongo Agaricia undata, que nos abrió los ojos para entender otra posible forma de enfrentar las peores predicciones del cambio climático, relacionadas con la microbioerosión y la acidificación oceánica [32]. Al principio, pensamos que las machas oscuras que se expandían desde la base de los corales hasta sus bordes eran una anomalía, algo así como una enfermedad coralina desconocida. Al observar en detalle, y realizar una identificación molecular, nos encontramos con algo muy interesante.
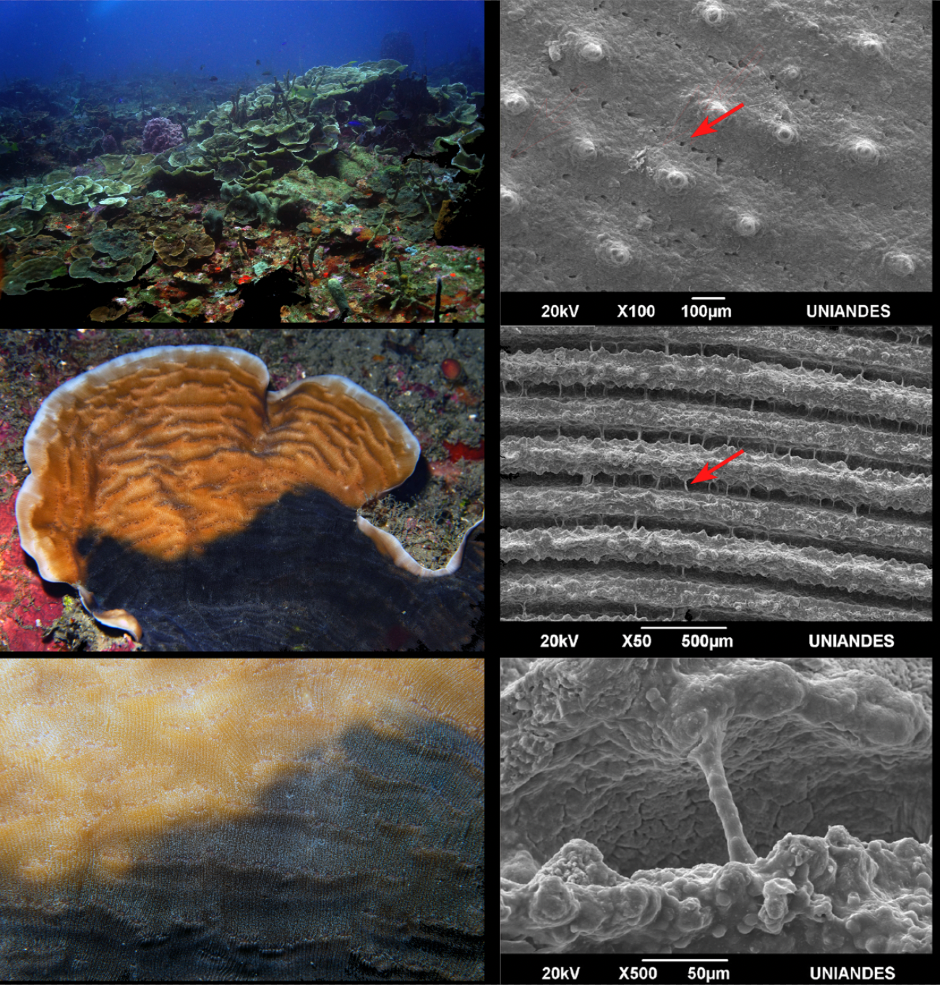 Figura 2. Corales y arrecifes coralino mesofóticos en el Bajo Trompadas, entre los treinta y cinco y sesenta metros de profundidad (Barú, Cartagena, Colombia). Las imágenes del lazo izquierdo muestran arriba el paisaje del banco, que es dominado por varias especies de Agaricia, incluyendo Agaricia undata, coral hongo (fotografiado en detalle a sesenta metros de profundidad). El coral en detalle es Agaricia undata y las manchas oscuras en el coral pertenecen al alga endolítica Ostreobium (fotografía tomada por Juan A. Sánchez). A la derecha están las imágenes de microscopía electrónica de barrido de A. undata en la parte oscurecida. Las flechas rojas apuntan a estructuras construidas por Ostreobium en el esqueleto coralino, como poros (en las partes lisas del coral) y tuberías (entre las costas del coral que protegen su tejido blando), debajo un detalle de uno de estos tubos calcáreos construidos por el alga (sem tomado de [33],con permiso de Springer Nature).
Figura 2. Corales y arrecifes coralino mesofóticos en el Bajo Trompadas, entre los treinta y cinco y sesenta metros de profundidad (Barú, Cartagena, Colombia). Las imágenes del lazo izquierdo muestran arriba el paisaje del banco, que es dominado por varias especies de Agaricia, incluyendo Agaricia undata, coral hongo (fotografiado en detalle a sesenta metros de profundidad). El coral en detalle es Agaricia undata y las manchas oscuras en el coral pertenecen al alga endolítica Ostreobium (fotografía tomada por Juan A. Sánchez). A la derecha están las imágenes de microscopía electrónica de barrido de A. undata en la parte oscurecida. Las flechas rojas apuntan a estructuras construidas por Ostreobium en el esqueleto coralino, como poros (en las partes lisas del coral) y tuberías (entre las costas del coral que protegen su tejido blando), debajo un detalle de uno de estos tubos calcáreos construidos por el alga (sem tomado de [33],con permiso de Springer Nature).
Esperanza dentro de la roca
Las manchas oscuras en los corales hongo eran un alga endolítica del género Ostreobium. Se trata de un grupo de algas verdes que químicamente perforan la roca coralina haciéndola su casa. Técnicamente se conocen como euendolíticos, pues deben vivir obligatoriamente dentro de los esqueletos coralinos. Se posesionan cómodamente entre los organismos fotosintéticos más eficientes del planeta, pues utilizan menos del 0,1% de la luz que llega a la superficie del mar [34]. Una de las predicciones más preocupantes del cambio climático y la acidificación el océano es que la microbioerosión, es decir, la disolución química de la roca calcárea por la acción microbiana, causada por algas endolíticas aumentará significativamente, debido a la erosión de la roca coralina [35]. Ante los cambios en la química del agua que se predicen para final del siglo, los corales podrían terminar convertidos en arena por sus propios comensales. Sin embargo, unos estudios realizados en el mar Rojo sugerían un relacionamiento diferente con los corales. Durante eventos de blanqueamiento coralino se observó cómo las algas endolíticas subieron hasta la superficie del coral y, mediante marcaje del carbono se constató experimentalmente que ocurría una transferencia de productos de la fotosíntesis al coral, que durante el blanqueamiento se encontraba prácticamente carente de energía por parte de las zooxantelas [36,37]. Desde entonces, ha resonado la idea de que Ostreobium sea un simbionte mutualista del coral y no un peligroso e indeseable comensal.
¿Tendrán los corales un arsenal de escondido de fotosimbiontes más aptos ante el cambio climático?Para que las algas endolíticas se puedan considerar como un recurso similar a las zooxantelas deben cumplir con algunos supuestos mínimos para una asociación estrecha entre coral-endosimbionte. Primero, debe haber evidencia de que estas algas interactúan con el tejido coralino; si bien se tenía evidencia de traslocación de productos de la fotosíntesis en los experimentos del mar Rojo durante eventos de blanqueamiento, se necesitaba evidencia de que en condiciones normales el coral se comunicaba de alguna forma con las algas endolíticas. Las manchas oscuras de los corales hongo Agaricia proporcionaron con creces esta evidencia; justo en la zona oscurecida de las hojas de coral se encontraron evidencias de una relación estrecha entre las algas con el tejido coralino. El dedicado trabajo de Sebastián Gómez y Fanny González, estudiantes de pregrado y posgrado de Ciencias Biológicas de la Universidad de los Andes, demostraron que no solamente se encontraban los abundantes filamentos del alga en la zona oscurecida, sino que sus filamentos afloraban en poros sobre la superficie del esqueleto justo donde está el tejido vivo del coral —la matriz de calcificación más específicamente—. Aún más sorprendente, el alga construía unas tuberías que atravesaban las laminillas del tejido coralino justo donde descansa el tejido vivo de los pólipos coralinos (figura 2). La relación entre las algas endolíticas y el coral hongo no se limitaba a un evento de blanqueamiento, la relación íntima con el tejido coralino quedaba esculpida en su propio esqueleto.
Otro supuesto entre la asociación de corales y fotosimbiontes es que debe existir un amplio repertorio de especies endosimbióticas que, como en el caso de las zooxantelas (Symbiodinaceae), también han ampliado el lienzo adaptativo para los corales en las diversas dimensiones ambientales y oceanográficas como; la profundidad, la penetración de la luz y las diversas condiciones locales que puede ofrecer un arrecife coralino [38]. Aunque se han incrementado las investigaciones científicas sobre zooxantelas y por tanto el conocimiento sobre ellas, para el caso de Ostreobium los estudios en ecología molecular hasta la actualidad son más bien escasos (incluyendo los nuestros). El coral hongo también resulta ser un buen modelo para poner a prueba este tipo de relaciones; en un estudio pudimos examinar los mismos especímenes de Agaricia undata de los cuales conocíamos ya sus zooxantelas para luego identificar el tipo de algas endolíticas Ostreobium. Nuevamente, quedamos muy sorprendidos. Cerca de ochenta corales colectados en tres localidades y tres rangos de profundidad, incluyendo dos zonas de la región mesofótica, se asociaron con siete tipos de zooxantelas del género Cladocopium. Aunque solo obtuvimos secuencias de Ostreobium para un tercio de los especímenes de A. undata estudiados, la diversidad de endosimbiontes con al menos doce linajes de Ostreobium, fue mucho mayor que de las zooxantelas (figura 3b). Los resultados excedieron las expectativas.
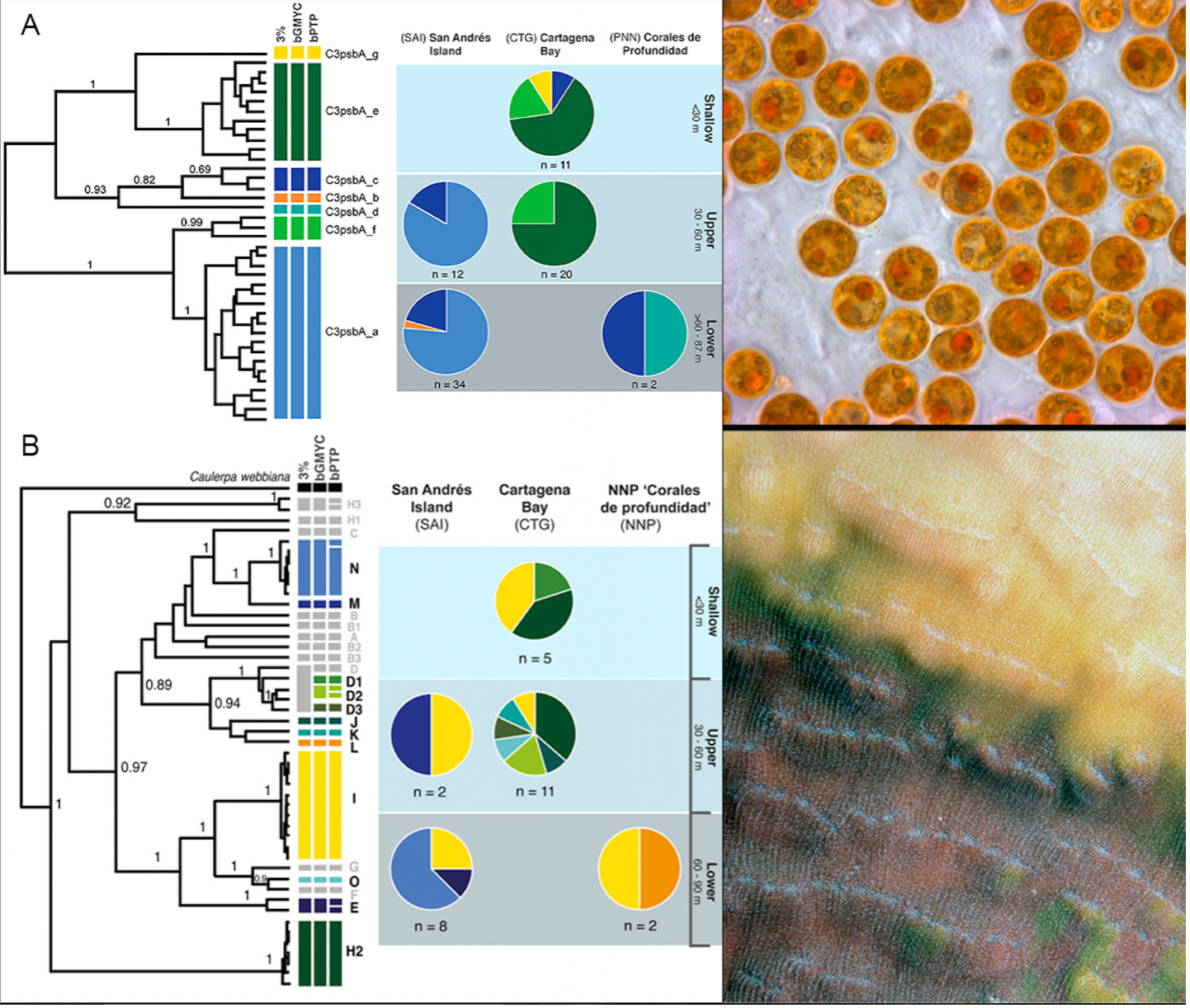 Figura 3. Identificación molecular de los endosimbiontes del coral hongo Agaricia undata en tres localidades del Caribe colombiano (Isla de San Andrés, Cartagena y el Parque Nacional Natural Corales de Profundidad). Las barras de colores a la derecha de la filogenia representan el agrupamiento de las otu, en función de los umbrales de distancia genética (3 %); en los gráficos circulares se resumen la diversidad y distribución de las otu de los endosimbiontes en el rango de profundidad por localidad, cuyos colores corresponden a los clados definidos en el árbol; los valores de Bootstrap se basan en análisis bayesianos, y solo se muestran probabilidades superiores al 60 % (ver detalles metodológicos en las fuentes originales). Sección A., panel superior con información de zooxantelas (Symbiodiniaceae) (tomado de [32]; zooxantelas, por Todd C. LaJeunesse, Flickr). Sección B., panel inferior con información del alga endolítica Ostreobium(tomado de [33] con permiso de Springer Nature, fotografías tomadas por Juan A. Sánchez).
Figura 3. Identificación molecular de los endosimbiontes del coral hongo Agaricia undata en tres localidades del Caribe colombiano (Isla de San Andrés, Cartagena y el Parque Nacional Natural Corales de Profundidad). Las barras de colores a la derecha de la filogenia representan el agrupamiento de las otu, en función de los umbrales de distancia genética (3 %); en los gráficos circulares se resumen la diversidad y distribución de las otu de los endosimbiontes en el rango de profundidad por localidad, cuyos colores corresponden a los clados definidos en el árbol; los valores de Bootstrap se basan en análisis bayesianos, y solo se muestran probabilidades superiores al 60 % (ver detalles metodológicos en las fuentes originales). Sección A., panel superior con información de zooxantelas (Symbiodiniaceae) (tomado de [32]; zooxantelas, por Todd C. LaJeunesse, Flickr). Sección B., panel inferior con información del alga endolítica Ostreobium(tomado de [33] con permiso de Springer Nature, fotografías tomadas por Juan A. Sánchez).
A raíz de los primeros estudios en la ecología molecular del microbioerosionador Ostreobium, iniciamos un programa de investigación de largo aliento en este tema, en el que la ecología molecular del endosimbionte es un elemento central. Los nuevos resultados apuntan a la dirección correcta. Gracias al trabajo de Amalia Murgueitio durante su pregrado, observamos que el resto de los congéneres de Agaricia presentan también estructuras tubulares y orificios de comunicación con Ostreobium.
Dos estudiantes de maestría, Adriana Rodríguez y Sebastián Giraldo Vaca, completaron la diversidad molecular de Ostreobium en corales del Caribe y Pacífico colombianos, respectivamente. Sus hallazgos se han basado en el análisis de filogenias datadas con especímenes fósiles, y muestran que la asociación del microbioerosionador con todos los corales es muy antigua, incluso anterior al momento en que los corales escleractínios fueran los principales constructores arrecifales. Asimismo, se encontró que Agaricia cuenta con la asociación más antigua dentro del grupo de los corales y que fue fundamental para que Ostreobium fuera un colonizador tan eficiente. En contraste, la relación entre zooxantelas y corales es mucho más reciente, y los procesos de coevolución y una gran especificidad han sido predominantes. ¿Quién se iba imaginar que todo esto pasara en un coral tipo «maleza»?
¿Quiénes depositarán la roca calcárea en el futuro?
Entrados en el Antropoceno, tanto los cambios ambientales como los sociales se están dando de forma acelerada. Hoy es imposible hacer predicciones sobre un futuro que genera, ante todo, una gran incertidumbre. El registro fósil muestra cómo la roca calcárea, matriz de los arrecifes tropicales, puede estar construida tanto de aragonita como de calcita, que son dos formas distintas de carbonato de calcio, dependiendo de las condiciones ambientales dominantes. Mientras más concentración de CO2 haya en la atmósfera, menor será la concentración de iones de carbonato en el océano y, por tanto, más difícil será construir biominerales carbonatados. Es así como la atmósfera preindustrial favoreció lasaturacióndearagonitayunamayorcalcificación, y la atmósfera actual es desfavorable para la calcificación. Si las concentraciones de CO2 en la atmósfera siguen aumentando, no podemos descartar un cambio del paisaje arrecifal en el que veremosmásoctocorales,quizásalmejasgigantes, y, posiblemente, muchas algas coralináceas con sus rodolitos. En nuestro programa de investigación actual, buscamos establecer un observatorio de la microbioerosión arrecifal, en el que estudiemos la calcificación en corales y otros organismos arrecifales, para hacerle seguimiento a los efectos de la acidificación oceánica y examinar de forma experimental las tasas de productividad y calcificación.
El investigador posdoctoral Carlos Edwin Gómez ha logrado instalar un laboratorio para investigar los efectos del cambio climático marino, mediante condiciones controladas de mesocosmos, en convenio con el Centro de Investigación Educación y Recreación (CEINER) en Islas del Rosario. Para este proyecto, en campo, se han utilizado botellas de incubación y se han medido los niveles de saturación de calcita y aragonita, gracias al convenio con Parques Nacionales Naturales (PNN Corales de Profundidad y PNN Islas del Rosario y San Bernardo). A diferencia de los monitoreos de temperatura, que requieren una infraestructura sencilla, monitorear la acidificación oceánica requiere de técnicas analíticas para cuantificaciones a nivel de moléculas. Bajo esta línea de investigación, Amalia Aschner realizó su trabajo de grado sobre la medición de la productividad y la fotosíntesis de un alga coralinácea que construye rodolitos. Ella demostró la capacidad excepcional de estas algas para fijar carbonato de calcio y la gran elasticidad de sus pigmentos fotosintéticos para evitar saturarse en las horas de más alta irradiación. Estas algas podrán construir roca calcárea incluso mejor que los corales.
A pesar de los proyectos mencionados antes, todavía hay mucho por aprender de los corales escleractínios. El hecho de que los corales se asocien tan íntimamente con su potencial enemigo, las algas microbioerosionadoras Ostreobium, nos llena de esperanza de que los corales duros continúen construyendo los arrecifes coralinos. Tal vez los arrecifes del futuro no estarán dominados por Acropora como durante la era preindustrial, pero sí serían arrecifes semejantes a los ecosistemas coralinos mesofóticos o a aquellos expuestos a la sedimentación del Caribe sur cerca de Cartagena. Si bien esto no es lo ideal en términos ecológicos, se podrían mantener algunos de los servicios ecosistémicos como, por ejemplo, proveer un hábitat para otras especies, incluidas especies de consumo humano; ofrecer lugares para el esparcimiento; y, muy importante, mantener un rol ecológico de regulación de los ciclos globales de los carbonatos. Finalmente, es muy importante destacar que cualquier esfuerzo humano para salvar una especie de su extinción, no es solamente destacado, sino justo, pues cualquier pérdida de biodiversidad causado por el cambio climático es responsabilidad colectiva de la humanidad. Las guarderías y viveros de coral han movilizado a la sociedad contra la extinción de los corales como ningún otro proyecto hasta el momento. Solo tengo admiración por su dedicación y entereza. Sin duda, estos procesos de rehabilitación de arrecifes coralinos podrían verse favorecidos al buscar otras especies y organismos calcificadores, y en evitar los estresores externos como la sobrepesca y el exceso de nutrientes provenientes de los ríos, que diezman la resiliencia coralina.
Agradecimientos
En casi veinte años de investigación del Laboratorio de Biología Molecular Marina (BIOMMAR) del Departamento de Ciencias Biológicas de la Universidad de los Andes, ningún proyecto de investigación habría sido posible sin el aporte de los estudiantes de pregrado y posgrado. ¡A todos ellos quiero darles mi eterno agradecimiento! Sea este el espacio para agradecer al Ministerio de Ciencia Tecnología e Innovación y a la Facultad de Ciencias de la Universidad de los Andes por la financiación y la gestión del programa Observatorio de la Microbioerosión, Acidificación Oceánica y la Disolución en Arrecifes Coralinos (contrato 80740- 489-2020, código 1204-852-70251).
Referencias
1. Hughes TP, Kerry JT, Álvarez-Noriega M, Álvarez-Romero JG, Anderson KD, Baird AH, et al. Global Warming and Recurrent Mass Bleaching of Corals. Nature. 2017; 543:373-377.
2. van Woesik R, Shlesinger T, Grottoli AG, Toonen RJ, Vega Thurber R, Warner ME, et al. Coral-bleaching Responses to Climate Change across Biological Scales. Glob Change Biol. 2022; 28(14): 4229-4250.
3. Leggat W, Whitney S, Yellowlees D. Is Coral Bleaching Due to the Instability of the Zooxanthellae Dark Reactions? Symbiosis. 2004; 37:137-153.
4. Hughes TP, Kerry JT, Baird AH, Connolly SR, Chase TJ, Dietzel A, et al. Global Warming Impairs Stock–Recruitment Dynamics of Corals. Nature. 2019; 568:387-390.
5. Young CN, Schopmeyer SA, Lirman D. A Review of Reef Restoration and Coral Propagation Using the Threatened Genus Acropora in the Caribbean and Western Atlantic. Bull Mar Sci. 2012; 88(4): 1075-1098.
6. Rinkevich B. Rebuilding Coral Reefs: Does Active Reef Restoration Lead To Sustainable Reefs? Curr Opin Environ Sustain. 2014;7: 28-36.
7. van Oppen MJH, Blackall LL. Coral microbiome dynamics, functions and design in a changing world. Nat Rev Microbiol. 2019 jul.; 17:557-567.
8. López-Angarita J, Moreno-Sánchez R, Maldonado JH, Sánchez JA. Evaluating Linked Social-Ecological Systems in Marine Protected Areas. Conserv Lett. 2014;7(3): 241-252.
9. Mumby PJ, Dahlgren CP, Harborne AR, Kappel CV, Micheli F, Brumbaugh DR, et. al. Fishing, Trophic Cascades, and the Process of Grazing on Coral Reefs. Science. 2006; 311(5757): 98-101.
10. Lapointe BE, Brewton RA, Herren LW, Porter JW, Hu C. Nitrogen Enrichment, Altered Stoichiometry, and Coral Reef Decline at Looe Key, Florida Keys, USA: a 3-Decade Study. Mar Biol. 2019;166: 108.
11. Moriarty T, Leggat W, Huggett MJ, Ainsworth TD. Coral Disease Causes, Consequences, and Risk within Coral Restoration. Trends Microbiol. 2020;28(10): 793-807.
12. Hoegh-Guldberg O, Poloczanska ES, Skirving W, Dove S. Coral Reef Ecosystems under Climate Change and Ocean Acidification. Front Mar Sci. 2017;4.
13. Masson-Delmotte VP, Zhai P, Pirani A, Connors SL, Péan C, Berger S, editores. Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change [Internet]. Cambridge, Nueva York: Cambridge University Press, IPCC [citado 2023 jul. 15]. 2391 p. Disponible en: https://report.ipcc.ch/ar6/wg1/IPCC_AR6_WGI_FullReport.pdf
14. Velásquez J, López-Angarita J, Sánchez JA. Evaluation of the FORAM Index in a Case of Conservation. Biodivers Conserv. 2011; 20: 3591-3603.
15. Stanley GD. The Evolution of Modern Corals and their Early History. Earth-Sci Rev. 2003; 60(3-4): 195-225.
16. Pandolfi JM, Kiessling W. Gaining Insights from Past Reefs to Inform Understanding of Coral Reef Response to Global Climate Change. Curr Opin Environ Sustain. 2014; 7: 52-58.
17. Quattrini AM, Rodríguez E, Faircloth BC, Cowman PF, Brugler MR, Farfan GA, et al. Palaeoclimate ocean conditions shaped the evolution of corals and their skeletons through deep time. Nat Ecol Evol. 2020; 4: 1531-1538.
18. Inoue S, Kayanne H, Yamamoto S, Kurihara H. Spatial Community Shift from Hard to Soft Corals in Acidified Water. Nat Clim Change. 2013; 3: 683-687.
19. Edmunds PJ, Tsounis G, Lasker HR. Differential Distribution of Octocorals and Scleractinians around St. John and St. Thomas, US Virgin Islands. Hydrobiologia. 2016; 767: 347-360.
20. Sánchez JA, Gómez-Corrales M, Gutierrez-Cala L, Vergara DC, Roa P, González-Zapata FL, et al. Steady Decline of Corals and Other Benthic Organisms in the SeaFlower Biosphere Reserve (Southwestern Caribbean). Front Mar Sci. 2019;6.
21. Gómez CE, Paul VJ, Ritson-Williams R, Muehllehner N, Langdon C, Sánchez JA. Responses of the Tropical Gorgonian Coral Eunicea fusca to Ocean Acidification Conditions. Coral Reefs. 2015; 34: 451-460.
22. Camargo C, Maldonado JH, Alvarado E, Moreno-Sánchez R, Mendoza S, Manrique N, et al. Community Involvement in Management for Maintaining Coral Reef Resilience and Biodiversity in Southern Caribbean Marine Protected Areas. Biodivers Conserv. 2009;18: 935–956.
23. Alvarez-Filip L, González-Barrios FJ, Pérez-Cervantes E, Molina-Hernández A, Estrada-Saldívar N. Stony Coral Tissue Loss Disease Decimated Caribbean Coral Populations and Reshaped Reef Functionality. Commun Biol. 2022;5(440): 1-10.
24. Neely KL, Lewis CL, Lunz KS, Kabay L. Rapid Population Decline of the Pillar Coral Dendrogyra cylindrus Along the Florida Reef Tract. Front Mar Sci. 2021;8.
25. Rodríguez L, Acosta A, González-Zapata FL, Gómez-Corrales M, Marrugo M, Alvarado-Ch EM, et al. Conservation at the Edge: Connectivity and Opportunities from Non-protected Coral Reefs Close to a National Park in the Colombian Caribbean. Biodivers Conserv. 2023; 32: 1493-1522.
26. Cáceres SM, Sánchez JA. Estrategias de crecimiento de un abundante coral formador de arrecifes en el Caribe sur. Rev Acad Colomb Cienc Exactas Físicas Nat. 2015; 39(152): 348-357.
27. Aronson RB, Precht WF, Macintyre IG. Extrinsic Control of Species Replacement on a Holocene Reef in Belize: the Role of Coral Disease. Coral Reefs. 1998; 17: 223–230.
28. Aronson RB, Macintyre IG, Wapnick CM, O’Neill MW. Phase Shifts, Alternative States, and the Unprecedented Convergence of Two Reef Systems. Ecology. 2004; 85(7): 1876-1891.
29. Prata KE, Riginos C, Gutenkunst RN, Latijnhouwers KRW, Sánchez JA, Englebert N, et al. Deep Connections: Divergence Histories with Gene Flow in Mesophotic Agaricia Corals. Mol Ecol. 2022; 31(9): 2511-2527.
30. Sánchez JA, González-Zapata FL, Prada C, Dueñas LF. Mesophotic Gorgonian Corals Evolved Multiple Times and Faster Than Deep and Shallow Lineages. Diversity. 2021;13(12): 650.
31. Sanchez JA, Gonzalez-Zapata FL, Dueñas LF, Andrade J, Pico-Vargas AL, Sarmiento A, et al. Corals in the Mesophotic Zone (40-115 m) at the Barrier Reef Complex from San Andrés Island (Southwestern Caribbean). Front Mar Sci. 2019; 6.
32. Gonzalez-Zapata FL, Bongaerts P, Ramírez-Portilla C, Adu-Oppong B, Walljasper G, Reyes A, et al. Holobiont Diversity in a Reef-Building Coral over Its Entire Depth Range in the Mesophotic Zone. Front Mar Sci. 2018;5: 29.
33. Gonzalez-Zapata FL, Gómez-Osorio S, Sánchez JA. Conspicuous Endolithic Algal Associations in a Mesophotic Reef-Building Coral. Coral Reefs. 2018; 37:705-709.
34. del Campo J, Pombert J-F, Šlapeta J, Larkum A, Keeling PJ. The ‘Other’ Coral Symbiont: Ostreobium Diversity and Distribution. ISME J. 2017;11: 296-299.
35. Tribollet A, Godinot C, Atkinson M, Langdon C. Effects of Elevated pCO2 on Dissolution of Coral Carbonates by Microbial Euendoliths. Glob Biogeochem Cycles. 2009;23(3): GB3008.
36. Fine M, Loya Y. Endolithic Algae: an Alternative Source of Photoassimilates During Coral Bleaching. Proc R Soc B Biol Sci. 2002; 269: 1205-1210.
37. Fine M, Roff G, Ainsworth TD, Hoegh-Guldberg O. Phototrophic Microendoliths Bloom during Coral “White Syndrome”. Coral Reefs. 2006; 25: 577-581.
38. LaJeunesse TC, Parkinson JE, Gabrielson PW, Jeong HJ, Reimer JD, Voolstra CR, et al. Systematic Revision of Symbiodiniaceae Highlights the Antiquity and Diversity of Coral Endosymbionts. Curr Biol. 2018; 28(16): 2570-2580.e6.


