Felipe Guhl Nannetti. Profesor Emérito del Departamento de Ciencias Biológicas.
Cuatro grandes revoluciones han marcado el rumbo de las ciencias biológicas. Desde su fundación, en 1959, el Departamento de Ciencias Biológicas (DCB) de la Universidad de los Andes ha alineado sus contenidos académicos para hacer frente a los diferentes retos tanto de investigación, como éticos que estas plantean. En este artículo se hace una revisión de los descubrimientos más importantes que han caracterizado cada una de estas revoluciones, los desafíos éticos que añaden un nivel de complejidad a estas innovaciones biológicas y los nuevos los compromisos del DCB y de comunidad científica para desatar el poder de la biología, al mismo tiempo que se sopesan los riesgos de estos descubrimientos.
A lo largo de la historia de la biología han existido grandes revoluciones, si entendemos el concepto de revolución como la introducción de un descubrimiento que es importante por sí mismo y que, además, da lugar a un cambio radical en el enfoque que hasta ese momento se le daba a la disciplina. No solo se trata del significado de la nueva información, sino también del efecto que tiene en el enfoque general de la disciplina y su impacto en la sociedad y en el pensamiento humano.
La primera gran revolución se produjo en 1860 con las teorías evolucionistas propuestas por dos naturalistas ingleses, Charles R. Darwin y Alfred R. Wallace, quienes postularon de manera simultánea la teoría del origen de las especies por selección natural y defendieron la universalidad del origen de los seres vivos, con lo que sentaron las bases de la biología moderna.

Foto 1. Fotografía de la publicación de Charles R. Darwin y Alfred R. Wallace «On the Tendency of Species to Form Varieties; and on the Perpetuation of Varieties and Species by Natural Means of Selection» publicado en el Zoological Journal of the Linnean Society 3, el 20 de agosto de 1858. Este texto lo leyó, por primera vez en público, el secretario de la Linnean Society de Londres, John Joseph Bennett, el 1.° de julio de 1858. Ninguno de los autores estuvo presente durante la lectura [1].
La segunda revolución fue el descubrimiento de la estructura de la molécula del ácido desoxirribonucleico, más conocido como ADN. Hace setenta años, los científicos Francis Crick, de Gran Bretaña, y James Watson, de Estados Unidos, gracias al trabajo previo realizado por la cristalógrafa londinense Rosalind E. Franklin, publicaron la famosa estructura de la doble hélice del ADN en un artículo de apenas una página, en la revista Nature.

Foto 2. Fotografía del artículo «Molecular Structure of Deoxypentose Nucleic Acids», publicado en la revista Nature, número 4356, el 25 de abril de 1953, páginas 737 a 738 [1].
A partir de ese momento, el rumbo de las ciencias biológicas cambió totalmente. Se abrieron nuevos horizontes que permitieron entender con mayor contundencia los postulados de Darwin- Wallace, es decir, cómo los seres vivos evolucionamos a partir de un ancestro común. También se despejaron todos los interrogantes sobre los fenómenos de la información hereditaria y de qué manera puede modificarse esa información por la ocurrencia de cambios azarosos (mutaciones) en las secuencias de los elementos que constituyen la doble hélice. Por coincidencia, también hace setenta años, gracias a la visión futurista de los fundadores de la Universidad de los Andes, nacieron los programas de Biología y Microbiología del Departamento de Ciencias Biológicas (DCB) en la Universidad y comenzaron sus actividades académicas e investigativas en esa época.
Como era de esperarse, los contenidos de los programas académicos se ajustan de acuerdo con los avances científicos; en el caso del DCB, esto incluyó la tercera gran revolución de las ciencias biológicas. Existe un hilo conductor entre las dos primeras revoluciones que nos lleva a la tercera gran revolución que continúa desarrollándose con una velocidad vertiginosa hasta nuestros días. Esta revolución ha sido el descubrimiento de la universalidad del diseño animal y de los procesos básicos de regulación de las funciones biológicas, el cual tiene grandes implicaciones para la humanidad y, quizás, ha sido la revolución que ha tenido mayores desarrollos tecnológicos hasta el día de hoy.
Si bien estos tres hechos han conducido a una nueva comprensión del fenómeno evolutivo y de la propia biología de los seres humanos, también ofrecen una nueva imagen de todos los procesos biológicos en el planeta y están llamadas a revolucionar la propia estructura de la sociedad humana.
La biología molecular
Los biólogos moleculares son los encargados de llevar a cabo los experimentos que se centran en investigar la estructura, función, procesamiento, regulación y evolución de las moléculas biológicas y sus interacciones. Esto permite comprender el funcionamiento de la vida a nivel micro y el modo en que la estructura de una molécula —incluidos detalles como la ubicación y la forma de los sitios activos de una proteína— afectan a su funcionamiento.
Uno de los avances más notables en este campo fue el desarrollo de la PCR —siglas en inglés para reacción en cadena de la polimerasa—, que se basa en las características de estabilidad al calor de una enzima polimerasa, cuyo hallazgo y posterior aplicación mereció el premio Nobel de Química, concedido a Kari Mullis y Michael Smith en 1993. Su importancia radica en que la PCR permite la amplificación (miles de veces) de una secuencia determinada del ADN, de manera tal que hoy en día su uso es muy común en centros de investigación, universidades y laboratorios de diagnóstico.
En la pandemia pasada, por ejemplo, como en tantas otras crisis de salud pública relacionadas con enfermedades infecciosas, la PCR se utilizó para determinar si una persona estaba infectada con el virus del SARS-COV-2 o no. Hoy en día, la PCR es un procedimiento muy frecuente en los análisis genéticos moleculares y constituye una herramienta poderosa para la construcción de árboles filogenéticos y otros estudios evolutivos. Es una técnica de amplificación del ADN tan precisa, que también se utiliza como herramienta jurídica para confirmar o desmentir parentescos familiares y casos en criminalística con un grado de exactitud del 99,99 %.
Descifrar genomas
Los avances para descifrar el código genético también se han desarrollado a gran velocidad. La secuenciación genética es una tecnología que permite conocer y descifrar el genoma que tienen todos los seres vivos. Se trata de «leer» ese código que contiene información imprescindible para su desarrollo y funcionamiento, como si se tratara de un libro de instrucciones. El orden en el que aparecen las secuencias que conforman el ADN (nucleótidos) corresponden a señas de identidad, que definen las características de cada organismo.
A mediados de la década de los setenta, Frederick Sanger desarrolló técnicas para secuenciar el ADN, por lo que recibió su segundo Nobel de Química en 1980 (el primero lo recibió en 1958, por sus estudios de la estructura de proteínas). Con la automatización de la secuenciación del ADN en la década de los ochenta, por primera vez, los biólogos y profesores universitarios propusieron la idea de analizar el genoma humano completo.
En junio del 2000 se anunció que la mayoría del genoma humano se había secuenciado y, en febrero del 2001, se publicó en la revista Nature el 90 % de la secuencia de los tres mil millones de pares de bases del genoma. Algunas de las sorpresas que acompañaron la publicación incluyeron el número relativamente pequeño de genes humanos —unos treinta mil—; la arquitectura compleja de las proteínas humanas comparadas con sus homólogos, por ejemplo, los nematodos y moscas de la fruta; y las lecciones que podían enseñar las secuencias repetidas de ADN. La secuenciación del genoma ha cambiado, de manera radical, múltiples campos, por ejemplo, nos ha permitido vincular variantes genéticas con enfermedades como el cáncer. También ha facilitado avances en nuestra comprensión de la evolución humana, ha mejorado el diseño de medicamentos y de la ciencia forense, y nos ha permitido genotipar de manera rápida los virus para comprender su patología y desarrollar tratamientos médicos.
Sin embargo, si bien hoy tenemos la tecnología para secuenciar el genoma de manera rápida y precisa, todavía nos falta mucha información cuando se trata de interpretar realmente lo que significa esa secuencia. Hay regiones del ADN de las que se desconoce su función y hay genes con funciones que no se comprenden bien. Incluso hay partes del genoma que, en realidad, nunca se secuenciaron por completo.
Durante los últimos diez años y, en consonancia con los adelantos de la tercera revolución biológica, la Vicerrectoría de Investigación y Creación de la Universidad de los Andes creó los centros satélites (core facilities) para apoyar, impulsar y facilitar el desarrollo de la investigación en el DCB a través de la prestación de servicios especializados con tecnología de alta calidad. A nivel internacional una inmensa cantidad de institutos de investigación están interesados en descifrar los genomas de todas aquellas plantas, animales, bacterias y virus para una mejor comprensión de todas sus funciones biológicas. Cada genoma proporciona nueva información desconocida y única de cada especie que demuestra especialización, pero, al mismo, tiempo muestra información común que nos permite conectar y entender los procesos más básicos que determinan la vida. El gráfico que aparece a continuación muestra el número creciente de genomas secuenciados desde el año 1997.
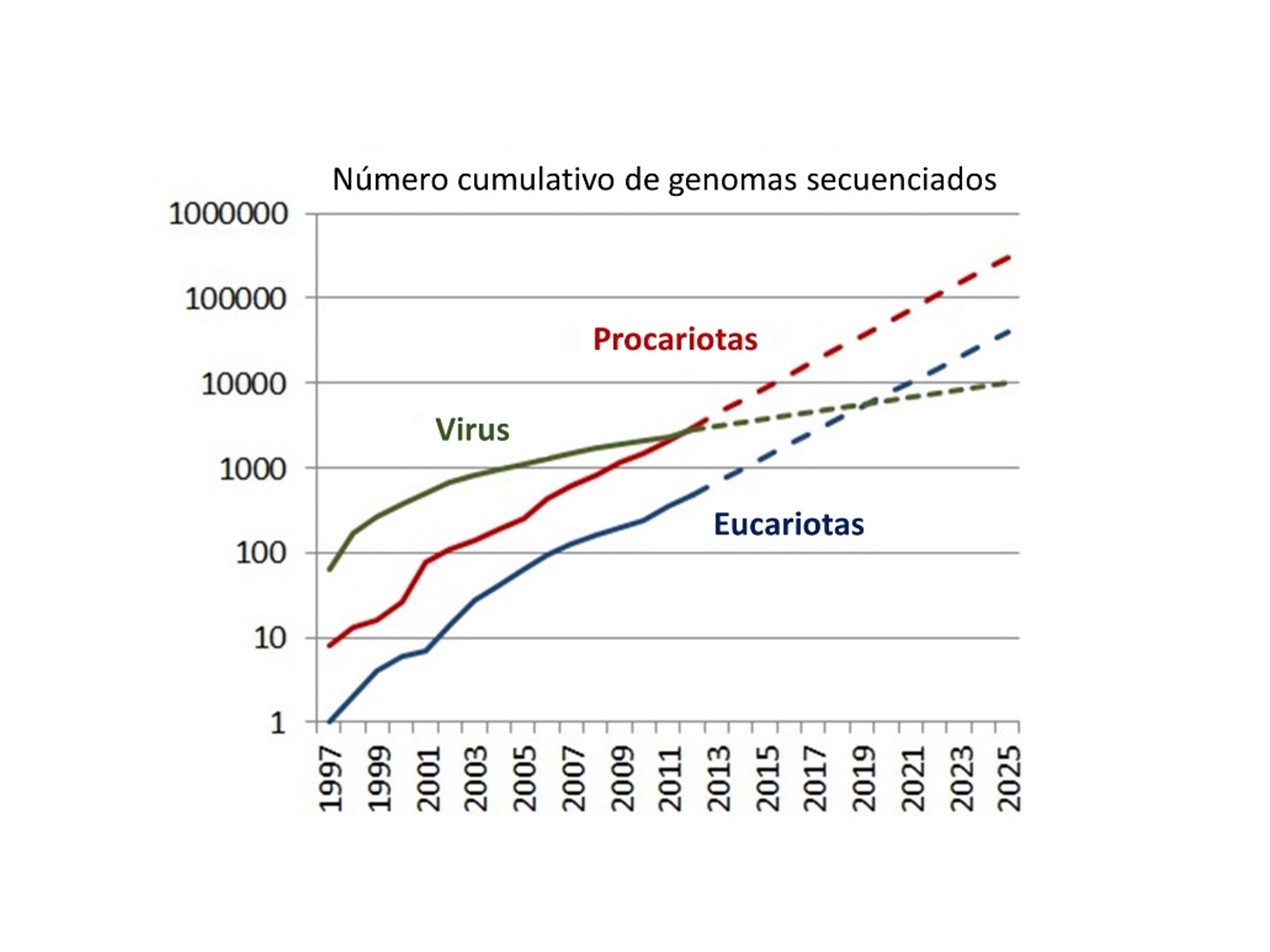
Foto 3. El número de genomas secuenciados aumenta de forma considerable a través del tiempo. Se muestra un crecimiento exponencial en bacterias (procariotas) teniendo en cuenta que al igual que los virus son las herramientas esenciales para el desarrollo biotecnológico. Las bacterias (en color rojo) muestran el mayor número de genomas secuenciados debido a su tamaño y relativo pequeño contenido de adn, seguido por plantas y animales (color azul) y los virus que son herramientas esenciales para el desarrollo biotecnológico [2].
El Laboratorio de Secuenciación GenCore, de la Universidad de los Andes, por ejemplo, fue el primero en realizar pruebas para la detección del COVID-19 y entregar información clave a las autoridades de salud para contrarrestar los efectos de la pandemia en Colombia. En este espacio, además, se pueden secuenciar muestras asociadas a humanos, sedimentos marinos, plantas, animales y patógenos de interés en salud pública. Los centros de servicios de la Universidad de los Andes están enfocados en las áreas de investigación con modelos animales, metabolómica, microscopía y computación de alto rendimiento para la investigación, y apoyo y divulgación científica de la biodiversidad.
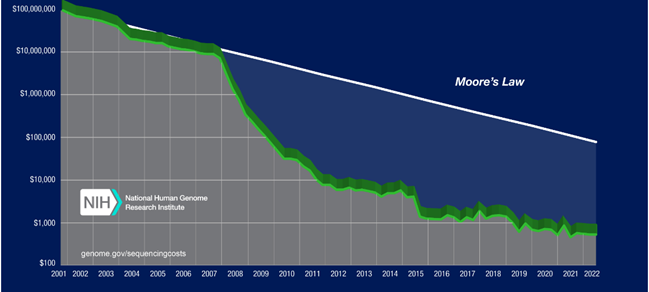
Foto 4. Los costos de secuenciación del genoma humano se han reducido a lo largo del tiempo gracias a los avances tecnológicos desde millones hasta cientos de dólares. Hoy en día, con por menos cien dólares, se puede obtener el genoma humano completo en pocos días. La gráfica del National Human Genome Research Institute (nih) da cuenta de cómo han disminuido los costos de secuenciación del genoma humano de 2001 a 2022 [3].
Las tijeras genéticas
El 7 de octubre del 2020 se otorgó el Nobel de Química a la profesora Emmanuelle Charpentier, directora de la Unidad Max Planck para la Ciencia de Patógenos en Berlín, y a la profesora Jennifer A. Doudna, de la Universidad de California en Berkeley, por describir un método de edición genómica. Su descubrimiento de las tijeras genéticas CRISPR-CAS9 [5] es uno de los avances científicos más importantes en lo que va del siglo, y hoy en día se lo reconoce ampliamente por su alta eficiencia, bajo costo y facilidad de diseño.

Foto 5. Las enzimas de restricción, producidas por las bacterias y sintetizadas en los laboratorios, reconocen sitios específicos de las secuencias de letras del adn y cortan para dejar un espacio en el que se pueden introducir secuencias de adn foráneo que expresen un gen específico. Esta tecnología se conoce como adn recombinante [1].
La tecnología de ADN recombinante consiste en la manipulación del material genético de un organismo específico para obtener características mejoradas y deseadas. Esto puede transformar la agricultura y la medicina e, incluso, hacer posible la cura de enfermedades hereditarias como la enfermedad de Huntington, la fibrosis quística y ciertos tipos de cáncer. CRISPR-CAS9 es una tecnología versátil, con aplicaciones infinitas en la edición genética, lo que incluye la capacidad de editar el genoma humano y plantea interrogantes sobre los límites de la intervención, cuestiones éticas, de patentes y políticas, que apenas se están empezando a analizar.
Entonces, ¿cómo podemos avanzar? La identificación de las funciones biológicas de los genes humanos es un proceso que se viene adelantando en los últimos años y la edición de genes CRISPR le ha dado un impulso significativo. Una vez se hayan generado estos datos, el siguiente paso será crear algoritmos de aprendizaje automático para buscar patrones y vincular variantes genéticas con sus funciones biológicas. Para esta y varias otras tecnologías de edición genética cada día toman más fuerza diferentes disciplinas como la ingeniería genética, la biotecnología, la biología sintética y la bioinformática. En contraste con el pasado, ahora se necesita trabajar en un equipo interdisciplinario en el que intervengan numerosos investigadores de diversas instituciones científicas. Hoy las tecnologías de punta nos proporcionan animales y plantas transgénicas, que se convierten en nuestro alimento: salmones de mayor tamaño; cabras que producen más carne y leche; plantas con mayores contenidos en proteínas y carbohidratos; tomates resistentes a las plagas; o soya que puede crecer en suelos muy áridos [2]. Se estima que la superficie sembrada con transgénicos a nivel mundial ronda las 190 millones de hectáreas. ¿Qué repercusiones tiene el consumo de estos productos?
En un mundo en el que la transformación genética avanza de forma rápida es necesario hacer una pausa y considerar las implicaciones de esta poderosa tecnología al sopesar sus potenciales ventajas y las consideraciones éticas que estas plantean. Al mantener altos estándares en los centros de investigación y promover prácticas responsables, podemos navegar por el intrincado panorama de la modificación genética y aprovechar su potencial para incrementar el bienestar tanto de la humanidad, como de otras especies.
La biología sintética
La biología sintética es una disciplina relativamente nueva que se originó en la década de los noventa como una extensión de la biología molecular y de la ingeniería genética. Se define como la síntesis de biomoléculas o la ingeniería de sistemas biológicos con funciones nuevas que no se encuentran en la naturaleza. La biología sintética, junto con la nanobiotecnología, representa una de las fronteras más interesantes —y, obviamente, más sujetas a debate— de la capacidad que tenemos los humanos de modificar el ambiente a nuestro favor.
El procedimiento implica el diseño y construcción de un ADN vía computador, que se construye por síntesis química y, finalmente, se inserta en una célula autónoma, inicialmente en procariotas (bacterias) y, más recientemente, en células más complejas como las levaduras (eucariotas), por lo cual no se habla de vida artificial (in silico) sino de vida sintética. Se trata de una cuarta revolución con todas sus implicaciones, lo que representa tanto oportunidades como amenazas, y muchas preguntas éticas.
Los primeros avances en esta área se centraron en la construcción de circuitos lógicos genéticos y en la creación de organismos que podían realizar tareas útiles. Uno de los precursores más importantes de la biología sintética fue el genetista inglés Richard J. Roberts, quien recibió el Nobel de Medicina en 1993. En la década de los años noventa, Roberts comenzó a explorar la posibilidad de diseñar sistemas biológicos artificiales al utilizar tecnología de ingeniería genética y biología molecular.
En 2010, Craig Venter y su equipo anunciaron la creación del primer organismo sintético, una bacteria que contenía un genoma completamente fabricado en el laboratorio [5]. Este avance fue un hito importante en la biología sintética y abrió nuevas posibilidades para la creación de organismos artificiales con fines médicos y de biorremediación.
Poco tiempo después, el equipo liderado por Jef Boeke, de la Universidad de Nueva York (NYU), anunció la primera levadura que lleva dentro uncromosoma artificial diseñado por su equipo [7]. El grupo ensambló un cromosoma completo al juntar 273 871 fragmentos de ADN y aplicar losmismosprincipiosqueVenterparamodificarun ser mucho más complejo: la levadura, a diferencia de las bacterias, tiene dieciséis cromosomas y pertenece al gran grupo de los eucariotas, que engloba a todos los seres vivos con núcleos celulares.
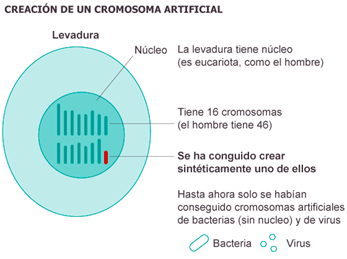
Foto 6. Por primera vez en la historia de la biología se ha logrado fabricar en el laboratorio un cromosoma (resaltado en color rojo) completo y funcional de un organismo superior la levadura Saccharomyces cerevisiae [6].
Según los investigadores, que el cromosoma sintético funcione en su entorno natural —una célula viva de levadura— es el verdadero hito del trabajo; el equipo pudo demostrar con este experimento que las células de levadura con el cromosoma sintético eran notablemente normales y que se comportan de forma casi idéntica a las levaduras naturales, salvo porque ahora poseen nuevas capacidades y pueden hacer cosas que sus versiones silvestres no pueden hacer.
La cuarta biorrevolución
En noviembre del 2020 el mundo celebró la noticia de las tres vacunas producidas por industrias biotecnológicas que habían resultado eficaces para poner fin a la prolongada pandemia que azotó al mundo por causa del virus SARS-COV-2. Ese mismo año se reportaron las mutaciones no deseadas generadas por la herramienta CRISPR-CAS9, cuando se utilizó para reparar un gen que producía ceguera en las primeras etapas de desarrollo del embrión humano, cuando se eliminaba un cromosoma completo o gran parte de él.
Ambos anuncios, difundidos con un mes de diferencia, ponen de manifiesto la promesa y el peligro de la ingeniería biológica. Hoy enfrentamos la cuarta revolución biológica que puede ayudarnos a solucionar grandes desafíos para la humanidad como mitigar el cambio climático, hacer grandes avances médicos, fortalecer la seguridad alimentaria e incidir de forma directa en el cumplimiento de los Objetivos de Desarrollo Sostenible (ODS) planteados por Naciones Unidas y aceptados por la mayoría de los países en el mundo para su cumplimiento en el año 2030. Para hacer realidad los beneficios de estas herramientas, tenemos que evaluar con mucho cuidado los riesgos potenciales que estas conllevan.
Se estima que aproximadamente el 60 % de los insumos físicos de la economía mundial se derivan de procesos biológicos. El nylon, por ejemplo, se puede producir a partir de levaduras genéticamente modificadas en lugar de utilizar petroquímicos. Muchos productos se podrán producir sin utilizartanta agua y energía, lo que generará menos emisiones de gases efecto invernadero (GEI). Más de cuatrocientas aplicaciones biológicas actualmente en desarrollo podrán reducir en un 10 % las GEI.
Recientemente se ha propuesto la formación de un consorcio de científicos a nivel multinacional para la creación de biocomputadores que funcionan con células cerebrales humanas. Este nuevo campo interdisciplinar se denomina inteligencia organoide (IO) y pretende que, a partir de organoides cerebrales (conjunto de neuronas) cultivadas en el laboratorio, se cree una nueva era de la bioinformática muy potente, más rápida y eficiente. Nos enfrentamos a la realidad de diseñar la vida. Hoy, por unos pocos dólares, una persona puede secuenciar su genoma completo. Kits de CRISPR-CAS están disponibles en el mercado y cualquier persona con cierto grado de conocimiento podría crear y liberar una nueva entidad viviente peligrosa o benéfica.
A los setenta años de creación del DCB debemos continuar generando consciencia sobre la complejidad de estas innovaciones biológicas y recalcar que se hace necesario que la comunidad científica, la sociedad en general y las entidades regulatorias cuenten con los elementos de juicio necesarios y las consideraciones éticas para evaluar su impacto en nuestras vidas. Solo el trabajo mancomunado puede liberar el poder de la biología y, al mismo tiempo, sopesar los riesgos de la cuarta biorrevolución que estamos viviendo.
Referencias
[1] Morata, G. El siglo del gen. Biología molecular y genética. En: Abbate J, Alonso S, Ávila J, Banerjee AV, Calvo-serraller F, Ceruzzi PE, et al. Fronteras del conocimiento [Internet]. Madrid: bbva, 2008. p. 161-169. [consultado el 27 de julio del 2023]. Disponible en: https://www.bbvaopenmind.com/wp-content/uploads/2009/01/BBVA-OpenMind-Fronteras_del_conocimiento.pdf
[2] Su, A. Sequenced genomes per year [Internet]. Scripps Research; 2013 jun. 11[consultado el 27 de julio del 2023]. Disponible en: http://sulab.org/2013/06/sequenced-genomes-per-year/.
[3] National Human Genome Research Institute (nih). dna Sequencing Costs: Data [Internet]. National Human Genome Research Institute (nih); fecha de publicación desconocida [consultado el 23 de julio del 2023]. Disponible en: https://www.genome.gov/about-genomics/fact-sheets/DNA-Sequencing-Costs-Data
[4] Bernal-Franco, D. crispr, una herramienta para editar el genoma que está revolucionando la ciencia [Internet]. biogenic Biólogos Genetistas Colombianos; 2015 oct. 8 [consultado el 23 de julio del 2023]. Disponible en: http://biogenic-colombia.blogspot.ca/2015/10/crispr-una-herramienta-para-editar-el.html
[5] Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, et al. The Sequence of the Human Genome. Nature. Science. 2001 febr 16;291(5507):1304-51.
[6] Sampedro, J. La vida artificial ya está aquí [Internet]. El País; 2014 mar. 28 [consultado el 27 de julio del 2023]. Disponible en: https://elpais.com/sociedad/2014/03/27/actualidad/1395944376_149099.html#?prm=copy_link


