Marío I. Ortiz*
María C. Carrasquilla**
Camila González***
De acuerdo con la Organización Mundial de la Salud (OMS), el cambio climático es considerado una de las mayores amenazas a la salud humana en el siglo XXI, pero ¿Qué es el cambio climático? Es el aumento, sin precedentes en el último milenio, en la tasa de calentamiento global, esto quiere decir, que la temperatura promedio del sistema climático de la tierra está incrementando día a día.
Existe consenso en la comunidad científica de que este aumento se debe, principalmente, a un incremento en las emisiones humanas de gases invernadero como, vapor de agua, dióxido de carbono (CO2), óxido nitroso (N2O), metano (CH4) y ozono (O3), que son gases atmosféricos que absorben y emiten calor. Más del 90% del impacto sobre el cambio climático, debido a CO2 y CH4, se asocia a emisiones generadas por el humano. Bajo el efecto del cambio climático la temperatura promedio global podría aumentar hasta 3,5°C en los próximos 50 años [1].

Figura 1.
El clima tiene un impacto especial en las enfermedades causadas por agentes infecciosos (bacterias, virus, parásitos, hongos, priones). Dentro de éstas, el calentamiento global influye directamente sobre la dinámica de un subgrupo de enfermedades que incluye las enfermedades transmitidas por el agua, las enfermedades transmitidas por vectores (ETV), y las enfermedades transmitidas por el suelo y alimentos. Las ETV son causadas por virus, parásitos y bacterias. Además, son transmitidas por artrópodos hematófagos (vectores) como mosquitos, flebótomos, triatominos y garrapatas y pequeños animales como caracoles.
Entre estas enfermedades se encuentra el dengue, el Zika, el chikunguña, la fiebre amarilla, la leishmaniasis, la malaria, la enfermedad de Chagas, las Rickettsiosis y la esquistosomiasis [1]. En el caso de los artrópodos hematófagos, éstos ingieren los patógenos al picar a una persona o un animal infectado, y posteriormente lo transmiten a una nueva persona o animal (Figura 1 y Figura 2). Las ETV representan más del 17% de todas las enfermedades infecciosas a nivel mundial [2]. Específicamente en el año 2020 en Colombia se notificaron 80.897 casos de malaria, 77.080 casos de dengue, 114 casos de Chagas y 6.158 de leishmaniasis [3]. Se prevé que las ETV serán el grupo de enfermedades infecciosas más sensibles al clima, debido a su susceptibilidad a un gran número de determinantes climáticos [4].

Figura 2.
¿Cómo afecta el cambio climático a las ETV?
Los vectores o artrópodos hematófagos que transmiten enfermedades infecciosas son sensibles a cambios en el clima por varias razones: 1) Son animales ectotérmicos, lo que quiere decir que su temperatura corporal interna es regulada por condiciones ambientales externas. 2) Su estado de desarrollo inmaduro (larvas, por ejemplo), generalmente requiere de la presencia de agua o de sustratos húmedos. 3) Las tasas de picadura tienden a incrementarse con la temperatura hasta un umbral superior, después del cual disminuyen. 4) El desarrollo y replicación, dentro de los vectores o en el ambiente, de los patógenos transmitidos, también ocurre más rápido a temperaturas altas [5].
Los datos obtenidos hasta el momento sugieren que, si el cambio climático presente y futuro no es mitigado, muy probablemente aumentará la temporada de transmisión y el rango geográfico de una gran variedad de enfermedades infecciosas. El impacto directo del cambio climático sobre los ecosistemas, en sinergia con la presión antropogénica, está afectando la biodiversidad, influyendo en el surgimiento y la transmisión de enfermedades infecciosas [6].
Por ejemplo, existe evidencia que la prevalencia de malaria aviar ha aumentado y que el cambio climático podría estar afectando los rangos altitudinales y latitudinales de la malaria aviar en aves silvestres [7,8]. La salud de los animales silvestres, en especial la de las aves, es un buen indicador de los efectos tempranos del cambio climático, debido a que ninguna medida de control o muy pocas se toman para proteger a estos animales [9], en otras palabras, las ETV podrían ser “el canario en la mina”, ya que son muy sensibles al clima y podrían ser la primera alerta a los cambios en los ciclos de las enfermedades por efecto del cambio climático.
El cambio climático puede afectar potencialmente la biología y distribución de los vectores y las infecciones transmitidas por estos. Cambios en la temperatura, en los vientos globales, la precipitación y la humedad relativa pueden incrementar la reproducción de los insectos y su densidad poblacional. Estos cambios pueden llevar a que las ETV, que normalmente afectan determinada área geográfica, aparezcan en nuevas áreas.
En particular, tenemos lo sucedido en Colombia y Etiopía desde 1970 con los brotes de Malaria; en 2014 se publicó uno de los primeros estudios que mostraba que los casos de malaria ocurren a elevaciones más altas en años más calurosos [10]. La temperatura también puede afectar el estado de salud o de enfermedad de los animales y humanos involucrados en los ciclos de las ETV [11]. Por ejemplo, la exposición crónica al estrés por calor bloquea el desarrollo de la respuesta inmune en varias especies de animales [12].
Una pregunta emerge con respecto a la compleja relación entre cambio climático y enfermedades infecciosas: ¿En qué medida los cambios temporales y espaciales recientes en las enfermedades infecciosas, son atribuidos al efecto del cambio climático? Esta pregunta es difícil de responder, la respuesta se ve obstaculizada por diferentes factores: 1) La falta de datos de buena calidad, que representen largos períodos de tiempo, sobre salud y clima; 2) Los varios factores no climáticos que se encuentran en juego; 3) La influencia de la variabilidad natural del clima que está sucediendo actualmente en un marco más cálido, por ejemplo, el fenómeno del niño [6].
Para ejemplificar esto se tiene la controversia sobre el peso real de los efectos del cambio climático sobre las variaciones observadas, en las zonas altas de África oriental, con respecto a la incidencia de malaria. Este aumento ha sido atribuido a un calentamiento regional [13]. A su vez, otros autores han publicado resultados, basados en datos de clima y en series temporales de casos, que demuestran que estas alteraciones en la incidencia de la enfermedad no se relacionan con cambios en el clima, y atribuyen estas variaciones, a un incremento en la resistencia del parásito a los medicamentos y a una disminución en las actividades de control vectorial en la zona [14].
También es importante tener en cuenta que en algunas zonas donde se está presentando o se prevé una reemergencia de estas enfermedades, en siglos y épocas pasadas, se había registrado transmisión. Por ejemplo, en Europa existen reportes de malaria que datan de los siglos IV y V a. C. y esta enfermedad fue relevante en este continente y en Estados Unidos hasta mediados de la década de 1950.
Los cambios en las ETV pueden estar sucediendo también en parte debido a otros factores: El establecimiento de personas a gran escala en nuevas zonas (frecuentemente asociado a un impacto ecológico), la acelerada urbanización y la alta movilidad a través de viajes aéreos [15].
Malaria
La malaria humana es causada por especies de parásitos pertenecientes al género Plasmodium, y es transmitida por las hembras de las especies de mosquitos del género Anopheles. El parásito Plasmodium falciparum es la especie que causa la forma clínica más severa y está ampliamente distribuida en los trópicos y África subsahariana, causando alrededor del 90% de los casos globales; otra especie de parásito relevante a nivel mundial es P. vivax [16]. Los mosquitos Anopheles necesitan de lluvia para que se formen sitios de cría que no se sequen durante un período de 9-12 días.
La multiplicación de los parásitos dentro de los mosquitos requiere de un mínimo de temperatura del aire de alrededor de 15-16 °C para P. vivax y de 19-20 °C para P. falciparum [17]. Los incrementos en temperatura cercanos al límite superior para la supervivencia tanto del vector como de los parásitos (alrededor de 35-37 °C), tienden a reducir la transmisión, mientras que un aumento en la temperatura diaria cerca del límite inferior, tiende a incrementarla [18].
El desarrollo económico y la implementación de medidas de intervención y control han llevado a una disminución global en la distribución espacial y endemicidad de la enfermedad durante las últimas décadas. Esto se ha logrado a pesar de las temperaturas globales en aumento, gracias a esfuerzos significativos de financiación para el control y la reducción de la carga impuesta por la malaria [19]. En contraste con esto, el número de infecciones reportadas con P. falciparum está incrementando en regiones altas tropicales como Nepal, África oriental y Colombia [10,20]. De igual forma, vectores competentes de malaria han sido encontrados a altitudes cada vez mayores [21,22].
Otro cambio observado en Colombia se relaciona con el hecho de que hasta el año 2015-2016 la especie más prevalente era P. vivax en una proporción de alrededor de 70% casos de P. vivax y 30% de P. falciparum. Esta proporción cambió y P. falciparum actualmente representa más del 50% de los casos de malaria en el país. Probablemente esto sea el resultado de cambios en los ciclos de transmisión, introducción de nuevas cepas del parásito, nuevos sitios de cría asociados a actividades antropogénicas y aumento de la temperatura ambiental [23].
Las futuras condiciones climáticas, obtenidas en diferentes simulaciones, son cada vez más apropiadas para la transmisión de malaria en regiones altas tropicales, en particular en África oriental y algunas regiones de Latinoamérica; de igual forma, se predice que el límite de la epidemia de malaria se desplazará hacia el sur en África subsahariana, por el contrario,los modelos muestran que en algunas regiones las condiciones de temperatura podrían llegar a ser intolerables para los vectores a finales del siglo XXI, principalmente en las planicies más cálidas del Sahel [24, 25]. En algunos países europeos como Grecia y España, se ha reportado la transmisión local, muy focalizada, de malaria por P. vivax, debido a migración humana, recortes en el presupuesto gubernamental y a olas de calor que han golpeado el sureste de Europa [26,27].
Enfermedad de Chagas
El parásito causante de la enfermedad de Chagas es el protista Trypanosoma cruzi, el cual se transmite al ser humano, con mayor frecuencia, por el contacto del tejido mucoso o heridas en la piel, con heces infectadas de los insectos hematófagos conocidos como triatominos o “pitos”. Cientos de especies de animales vertebrados se pueden infectar con el parásito y se encuentran también involucradas en los ciclos de transmisión de la enfermedad [28].
La enfermedad de Chagas es un importante problema de salud pública en América Latina, en donde se considera endémica en 21 países [15]. Más de 70 millones de personas están en riesgo de contraer la enfermedad, existen alrededor de 8 millones de personas actualmente infectadas, mueren alrededor de 12.000 y se generan 30.000 nuevas infecciones por año [15,29]. Así mismo, la enfermedad de Chagas se ha detectado cada vez más en las últimas décadas en regiones no endémicas, como el sur de Estados Unidos [28]. Los “pitos” se encuentran distribuidos ampliamente en el continente americano, desde Estados Unidos hasta Argentina.
En cuanto al cambio climático y la enfermedad de Chagas, proyecciones hechas hacia el 2050 y 2070, predicen cambios en la distribución de los vectores [15]. Existe evidencia que señala a los cambios en el clima, como los facilitadores de una mayor dispersión hacia Estados Unidos de las especies de “pitos” [29]. Para el caso de las especies de vectores más importantes, en términos epidemiológicos en América Latina, los efectos del clima son un poco confusos, debido a que varias de estas especies están relativamente protegidas frente al clima ya que habitan principalmente dentro de las viviendas [15].
En el norte de Sudamérica, especialmente en Colombia y Venezuela, el principal vector de T. cruzi es la especie Rhodnius prolixus. En Colombia, existen 66 municipios certificados libres de transmisión de T. cruzi, especialmente por R. prolixus domiciliado; el 100% de la sangre donada es analizada para presencia de T. cruzi; existen protocolos para atender y tratar al paciente chagásico y las muertes han disminuido en un 48%, pero a pesar de esto la enfermedad de Chagas sigue siendo un problema, especialmente en la orinoquía, donde se sobrelapan poblaciones vectoriales selváticas y domiciliadas [15].
En la orinoquía se presenta el fenómeno de reinfestación de las casas que ya han sido tratadas con insecticidas y se encontró que este tipo de reinfestación se da a partir de poblaciones de R. prolixus silvestres, que viven principalmente en las palmas cercanas a las casas. Estas poblaciones de triatominos podrán aumentar su contacto con los humanos y mejorar su eficiencia de transmisión del parásito como consecuencia del cambio climático [30].
Adicionalmente, se ha sugerido que un incremento en la temperatura causaría un aumento en el número de triatominos y una mayor probabilidad de infección [31]. De igual forma, un reciente estudio encontró triatominos infectados con T. cruzi en zonas a más de 2000 msnm, consideradas tradicionalmente regiones no endémicas en Colombia [32].
Leishmaniasis
La leishmaniasis se presenta en tres formas principales: cutánea, visceral y mucocutánea. La leishmaniasis cutánea es la forma más común de la enfermedad. La forma más grave, es la leishmaniasis visceral, la cual es mortal en el 95% de los casos, si no es tratada. El agente causal es un parásito del género Leishmania que se transmite a través de la picadura de insectos flebótomos infectados [33]. En Colombia se presenta la transmisión zoonótica (animal-vector-humano), en la cual está involucrado un animal como un roedor o un perro [34]. A nivel mundial, 350 millones de personas están en riesgo de infectarse y se calcula que cada año se presentan entre 700.000 y 1 millón de nuevos casos [33].
En Europa actualmente las especies de flebótomos se encuentran principalmente en la región mediterránea (Portugal, España, Italia, Croacia y Grecia). Los modelos de cambio climático proyectan que se va a presentar una expansión hacia el norte de la mayoría de las especies [35]. En Norte América, actualmente los casos de leishmaniasis corresponden generalmente a casos importados y ocasionalmente se reportan casos de leishmaniasis cutánea adquirida en Texas y Oklahoma [36]. Se proyecta que, con el cambio climático, más hábitats serán propicios para el desarrollo de especies de vectores y de reservorios presentes en el ciclo de la enfermedad, ampliando su distribución [37].
A nivel de América del Sur y Central, se proyecta que tanto la leishmaniasis cutánea como la visceral presentarán una disminución en su distribución geográfica bajo escenarios de cambio climático, posiblemente por su asociación a una baja estacionalidad en temperatura y precipitación, ya que con el cambio climático se espera un aumento en la estacionalidad en estas dos variables. Se proyecta que el rango de distribución de la leishmaniasis cutánea se disminuirá entre un 35 y 50% y el de la leishmaniasis visceral entre un 15 y 18%. Esta disminución proyectada es a nivel de región, sin embargo, en algunas áreas se va a mantener o podría aumentar la distribución [38].
En Colombia, los vectores de leishmaniasis visceral son Pintomyia evansi y Lutzomyia longipalpis. Estas especies, al igual que las diferentes especies de flebótomos son muy sensibles a la precipitación, ya que sus huevos son colocados en suelos húmedos. Las proyecciones en su distribución varían de acuerdo con los escenarios de cambio climático establecidos. En un escenario pesimista, es decir si se presenta un mayor calentamiento global, se proyecta una reducción en el área de distribución de ambas especies. Con respecto a la distribución altitudinal, se predice que la especie L. longipalpis va a aumentar en zonas intermedias y disminuir en zonas bajas. Para la especie P. evansi se prevé que va a mantener su actual distribución altitudinal [39].
Dengue:
Los mosquitos Ae. aegypti y Ae. albopictus son los vectores principales del virus dengue, del cual se reconocen cuatro versiones antigénicas diferentes o serotipos. Esta enfermedad se presenta especialmente en áreas urbanas y semi-urbanas de regiones tropicales y subtropicales y el ciclo de transmisión se da principalmente entre mosquitos y humanos. El número de casos de dengue ha aumentado a nivel mundial en las últimas décadas. Antes de 1970, únicamente nueve países habían tenido epidemias de dengue grave. Actualmente es una enfermedad endémica en más de 100 países. Además, nuevamente se ha propagado el virus a zonas como Europa [40].
Los rangos para la transmisión viral son entre 21,3–34˚C para el mosquito Ae. aegypti y 19,9–29,4˚C para Ae. albopictus. Se proyecta que, en el próximo siglo, se amplíe la distribución de estos vectores, especialmente en regiones templadas y zonas elevadas de áreas subtropicales y tropicales. El riesgo de transmisión del virus del dengue, especialmente por Ae. albopictus, posiblemente disminuirá en algunas zonas, como los trópicos, si eventualmente se vuelven demasiado calientes [41].
En Colombia, con el paso de los años se ha reportado la presencia del mosquito Ae. aegypti en zonas de mayor elevación. Hasta 1981, la mayor altitud a la cual se había registrado el mosquito era de 1.585 msnm. Sin embargo, en ese año, se reportó en 22 municipios por encima de los 1.600 msnm, incluyendo Málaga, Santander, donde se registró a 2.200 msnm [42]. En un reporte del 2016, se encontró esta especie a altitudes entre 1882 y 2302 msnm en Bello, Antioquia, incluyendo mosquitos positivos para el virus de dengue a 1.984 msnm [43].
En conclusión, se espera un cambio en la distribución geográfica de las enfermedades transmitidas por vectores, posiblemente con expansiones en algunas regiones y reducciones en otras. Por lo tanto, se prevé que en nuevas áreas se pueda presentar transmisión, como en zonas altas, afectando a poblaciones humanas no expuestas previamente (Figura 3). Sin embargo, es necesario aumentar el conocimiento sobre el estado actual de los ciclos de transmisión, la distribución de los vectores, así como los cambios en la distribución que puedan estar teniendo los mamíferos involucrados en los ciclos. Es importante disminuir al máximo el impacto antropogénico en las condiciones climáticas, para evitar el surgimiento de nuevos escenarios de transmisión y de nuevas amenazas en salud pública.
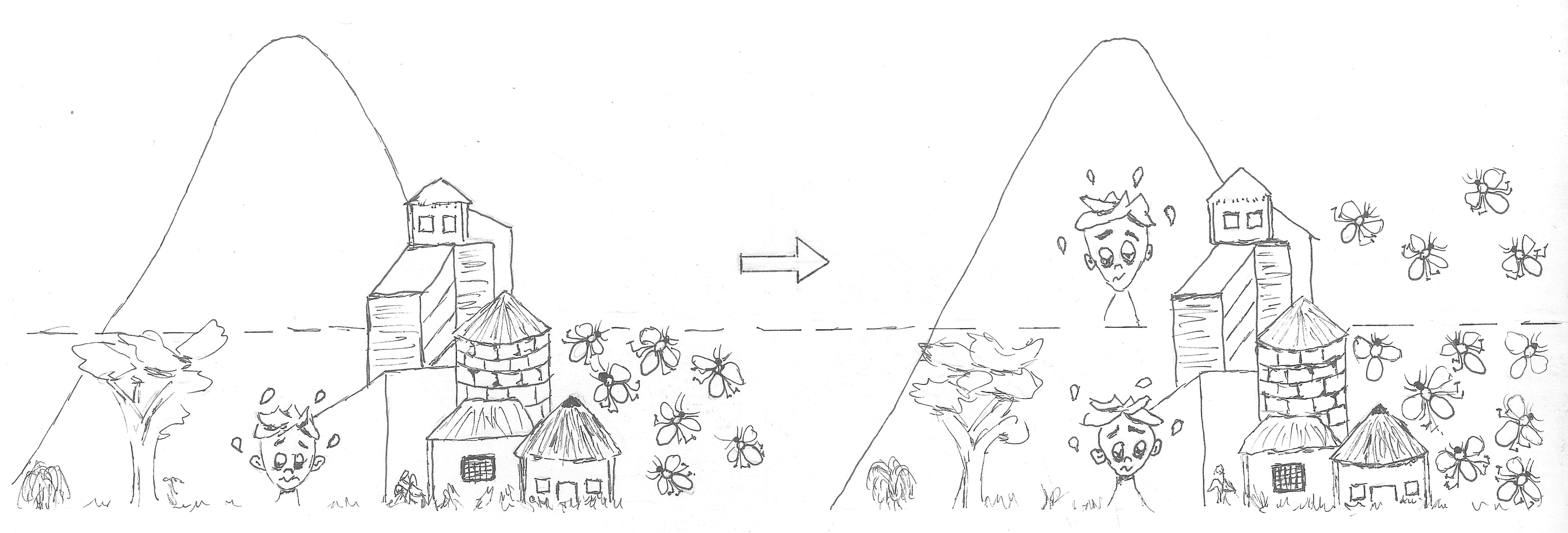
Figura 3.
* PhD, investigador posdoctoral del Departamento de Ciencias Biológicas de la Universidad de los Andes
** PhD, investigadora posdoctoral del Departamento de Ciencias Biológicas de la Universidad de los Andes
*** PhD, profesora asociada del Departamento de Ciencias Biológicas de la Universidad de los Andes
Figuras
Figura 1. La leishmaniasis y la enfermedad de Chagas tienen principalmente un ciclo de transmisión zoonótica (animal-vector-humano), en el cual se transmite el parásito del animal al humano por medio del vector. Ilustración: María Lucía Carrasquilla
Figura 2. La transmisión de dengue y malaria se da principalmente entre mosquitos vectores y humanos. Ilustración: María Lucía Carrasquilla
Figura 3. Un efecto atribuible al cambio climático en relación con las enfermedades transmitidas por vectores es el aumento del área afectada, involucrando nuevas zonas a mayor altura. Ilustración: María Lucía Carrasquilla
Referencias
[1] Biswas BK. Effect of climate change on vector-borne disease. In: Emerging Issues in Climate Smart Livestock Production. Elsevier; 2022.
[2] Organización Mundial de la Salud (OMS). Enfermedades transmitidas por vectores. 2020. https://www.who.int/es/news-room/fact-sheets/detail/vector-borne-diseases. Consultado febrero 28 del 2022.
[3] Sistema Nacional de Vigilancia en Salud Pública. Instituto Nacional de Salud (SIVIGILA). 2020. http://portalsivigila.ins.gov.co/Paginas/Vigilancia-Rutinaria.aspx. Consultado marzo 15, 2022.
[4] McIntyre K, Setzkorn C, Hepworth P, Morand S, Morse A, Baylis M. Systematic assessment of the climate sensitivity of important human and domestic animals’ pathogens in Europe Sci Rep. 2017; 7(1): 7134.
[5] Reisen W, Fang Y, Martinez V. Effects of temperature on the transmission of West Nile virus by Culex tarsalis (Diptera: Culicidae). J Med Entomol. 2006; 4(3): 309-317.
[6] Caminade C, McIntyre KM, Jones AE. Impact of recent and future climate change on vector-borne diseases. Ann NY Acad Sci. 2019; 1436: 157-173.
[7] Garamszegi LZ. Climate change increases the risk of malaria in birds. Glob Change Biol. 2011; 17: 1751–1759.
[8] Zamora-Vilchis I, Williams SE, Johnson CN. Environmental temperature affects prevalence of blood parasites of birds on an elevation gradient: implications for disease in a warming climate. PLoS One. 2012; 7: e39208.
[9] Reperant LA, Fuckar NS, Osterhaus AD, Dobson A, Kuiken T. Spatial and temporal association of outbreaks of H5N1 influenza virus infection in wild birds with the 0°C isotherm. PLoS Pathog. 2010; 6: e1000854.
[10] Siraj AS, Santos-Vega M, Bouma MJ, Yadeta D, Ruiz D, Pascual M. Altitudinal changes in malaria incidence in highlands of Ethiopia and Colombia. Science. 2014; 343(6175): 1154–1158.
[11] Rabinowitz P, Conti L. Links among human health, animal health, and ecosystem health. Annu Rev Public Health. 2013; 34: 189–204.
[12] Regnier JA, Kelley KW. Heat- and cold-stress suppresses in vivo and in vitro cellular immune responses of chickens. Am J Vet Res. 1981; 42(2): 294-299.
[13] Alonso D, Bouma MJ, Pascual M. Epidemic malaria and warmer temperatures in recent decades in an East African highland. Proc Biol Sci R Soc. 2011; 278: 1661–1669.
[14] Hay SI, Rogers DJ, Randolph SE, Stern D, Cox J, Shanks D, Snow R. Hot topic or hot air? Climate change and malaria resurgence in East African highlands. Trends Parasitol. 2002; 18(12): 530–534.
[15] Moreira de Souza R, Gorla D, Chame M, Jaramillo N, Monroy C, Diotaiuti L. Chagas disease in the context of the 2030 agenda: global warming and vectors. Mem Inst Oswaldo Cruz. 2021; 116: e200479.
[16] World Health Organization (WHO). World Malaria Report 2021. An in-depth update on global and regional malaria data and trends. 2021.
[17] Martens WJM, Jetten TH, Focks DA. Sensitivity of malaria, schistosomiasis and dengue to global warming. Clim Change. 1997; 35: 145–156.
[18] Paaijmans KP, Blanford S, Bell AS, Blanford JI, Read AF, Thomas MB. Influence of climate on malaria transmission depends on daily temperature variation. Proc Natl Acad Sci. USA. 2010; 107: 15135–15139.
[19] Feachem RG, Phillips AA, Hwang J, Cotter C, Wielgosz B, Greenwood B, Sabot O, Rodríguez M, Abeyasinghe R, Ghebreyesus T, Snow R. Shrinking the malaria map: progress and prospects. Lancet. 2010; 376(9752): 1566–1578.
[20] Zhou G, Afrane AY, Vardo-Zalik AM, Atieli H, Zhong D, Wamae P, Himeidan Y, Minakawa N, Githeko A, Yan G. Changing patterns of malaria epidemiology between 2002 and 2010 in Western Kenya: the fall and rise of malaria. PLoS One. 2011; 6: e20318.
[21] Dhimal M, Ahrens B, Kuch U. Species composition, seasonal occurrence, habitat preference and altitudinal distribution of malaria and other disease vectors in eastern Nepal. Parasites Vectors. 2014; 7: 540.
[22] Pinault LL, Hunter FF. New highland distribution records of multiple Anopheles species in the Ecuadorian Andes. Malar J. 2011; 10: 236.
[23] Laborde-Cárdenas C, Correa-Pérez E, Cuadras-Arena L, Aramendiz-Maestra K, Pareja-Loaiza P, Maestre-Serrano R. Caracterización epidemiológica de pacientes con malaria, notificados por un asegurador en salud en Colombia, 2016-2017. Rev Cuba Med Trop. 2020; 72(1): e436.
[24] Ermert V, Fink AH, Morse AP, Heiko P. The impact of regional climate change on malaria risk due to greenhouse forcing and land-use changes in tropical Africa. Environ. Health Perspect. 2012; 120: 77–84.
[25] Rogers DJ, Randolph SE. The global spread of malaria in a future, warmer world. Science. 2000; 289: 1763–1766.
[26] Andriopoulos P, Economopoulou A, Spanakos G, Assimakopoulos G. A local outbreak of autochthonous Plasmodium vivax malaria in Laconia, Greece—a re-emerging infection in the southern borders of Europe? Int J Infect Dis. 2013. 17: e125–e128.
[27] Velasco E, Gomez-Barroso D, Varela C, Diaz O, Cano R. Non-imported malaria in non-endemic countries: a review of cases in Spain. Malar J. 2017; 16: 260.
[28] Busselman R, Hamer S. Chagas disease ecology in the United States: Recent advances in understanding Trypanosoma cruzi transmission among triatomines, wildlife, and domestic animals and a quantitative synthesis of vector–host interactions. Annu Rev Anim Biosci. 2022; 10: 325-48.
[29] Graves B. Climate change and Chagas disease in The Americas: A qualitative systematic review. [Tesis de Maestría]: UT School of Public Health Dissertations. 2019; 87.
[30] Cordovez J, Rendón L, González C, Guhl F. Using the basic reproduction number to assess the effects of climate change in the risk of Chagas disease transmission in Colombia. Acta Trop. 2014; 129: 74-82.
[31] Tamayo LD, Guhl F, Vallejo GA, Ramírez JD. The effect of temperature increases on the development of Rhodnius prolixus and the course of Trypanosoma cruzi metacyclogenesis. Plos Negl Trop Dis. 2018; 12 (8): e0006735.
[32] Cantillo-Barraza O, Medina M, Zuluaga S, Blanco MI, Caro R, Jaimes-Dueñez J, Beltrán V, Xavier S, Triana-Chávez O. Distribution and natural infection status of synanthropic triatomines (Hemiptera:Reduviidae), vectors of Trypanosoma cruzi, reveals new epidemiological scenarios for chagas disease in the Highlands of Colombia. PLoS Negl Trop Dis. 2021; 15(7): e0009574.
[33] World Health Organization (WHO). Leishmaniasis. 2022. https://www.who.int/es/news-room/fact-sheets/detail/leishmaniasis. Consultado marzo 3, 2022.
[34] Roque ALR, Jansen AM. Wild and synanthropic reservoirs of Leishmania species in the Americas. Int J Parasitol Parasites Wildl. 2014; 251–262.
[35] Koch LK, Kochmann J, Klimpel S, Cunze S. Modeling the climatic suitability of leishmaniasis vector species in Europe. Scientific Reports. 2020; 7: 13325
[36] Centers of Disease Control and Prevention (CDC) 2020.
https://www.cdc.gov/parasites/leishmaniasis/index.html Consultado marzo 1 2022.
[37] González C, Wang O, Strutz SE, González-Salazar C, Sánchez-Cordero V, Sarkar S. Climate change and risk of leishmaniasis in North America: Predictions from ecological niche models of vector and reservoir species. PLoS Negl Trop Dis. 2010; 4(1): e585.
[38] Purse BV, Masante D, Golding N, Pigott D, Day JC, Ibañez-Bernal S, Kolb M, Jones L. How will climate change pathways and mitigation options alter incidence of vector-borne diseases? A framework for leishmaniasis in South and Meso America. PLoS ONE. 2017; 12(10): e0183583.
[39] González C, Paz A, Ferro C. Predicted altitudinal shifts and reduced spatial distribution of Leishmania infantum vector species under climate change scenarios in Colombia. Acta Trop. 2014; 129: 83–90.
[40] World Health Organization (WHO). Dengue and severe dengue. 2022. https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue. Consultado marzo 3, 2022.
[41] Ryan SJ, Carlson CJ, Mordecai EA, Johnson LR. Global expansion and redistribution of Aedes-borne virus transmission risk with climate change. PLoS Negl Trop Dis. 2019; 13 (3): e0007213.
[42] Suárez M, Nelson M. Registros de altitud del Aedes aegypti en Colombia. Biomédica. 1981; 1(4):4.
[43] Ruiz-López F, González-Mazo A, Vélez-Mira A, Gómez GF, Zuleta L, Uribe S, Vélez-Bernal ID. Presencia de Aedes (Stegomyia) aegypti (Linnaeus, 1762) y su infección natural con el virus del dengue en alturas no registradas para Colombia. Biomédica. 2016; 36(2): 303-308.


